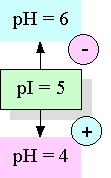|
3 色層分析法︰ |
|||||||||||||
|
3.1 色層分析法原理: |
TOP ▲ |
||||||||||||
|
a. 系統組成 |
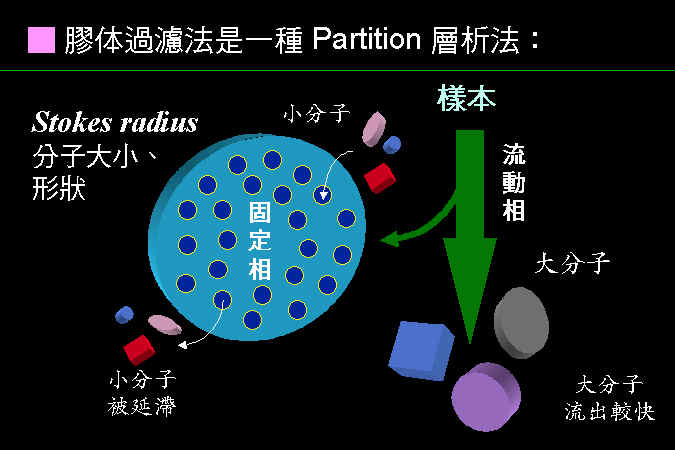
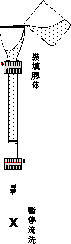
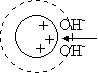
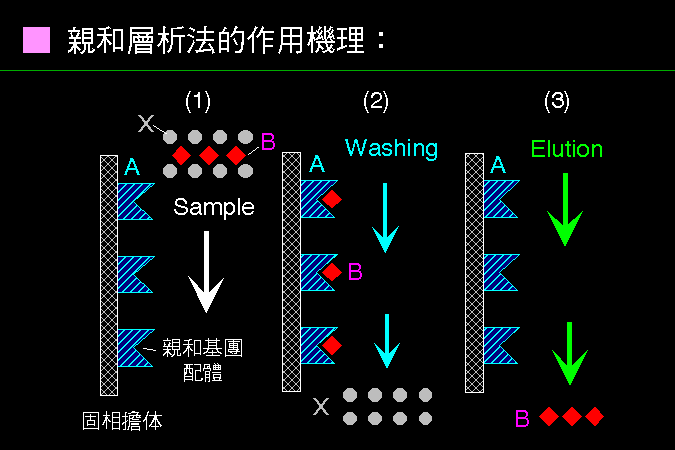
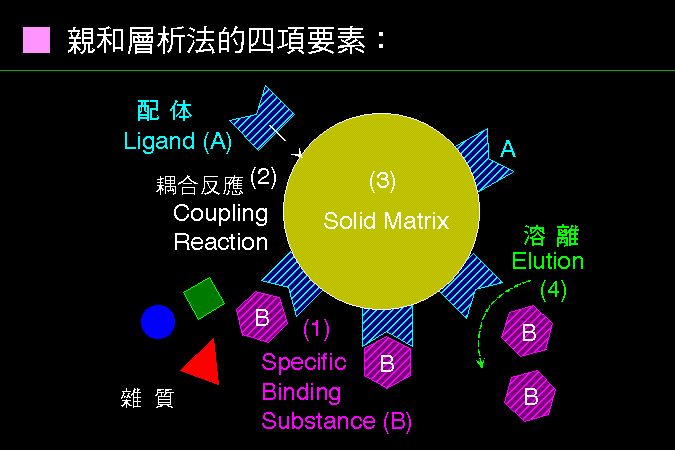
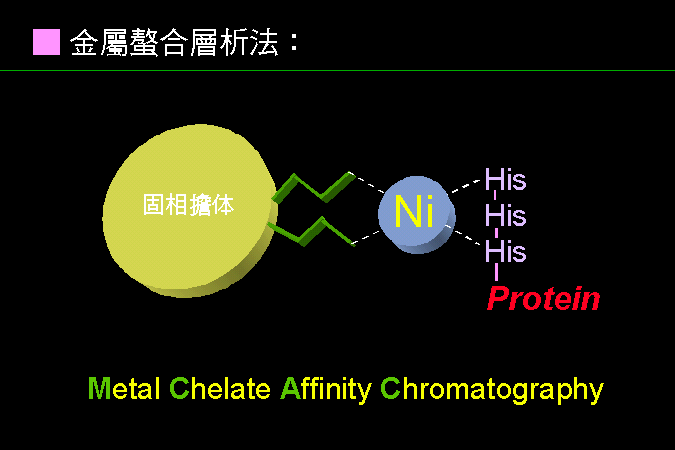
層析系統的兩個主要組成為 固定相 (stationary phase) 及 流動相 (mobile phase),二者各有不同的極性或非極性強度;樣本分子因其自身極性的強弱,與此二相之親和力不同。 與固定相親和力大者,易留滯原地; 與流動相親和力大者,易隨流動相移動,因而達成分離的目的。 圖 3.1 以圖解說明此一機制。 |
|
|||||||||||
|
|
|||||||||||||
|
圖 3.1 色層分析方法的基本原理圖解 |
|||||||||||||
|
b. 極性大小 |
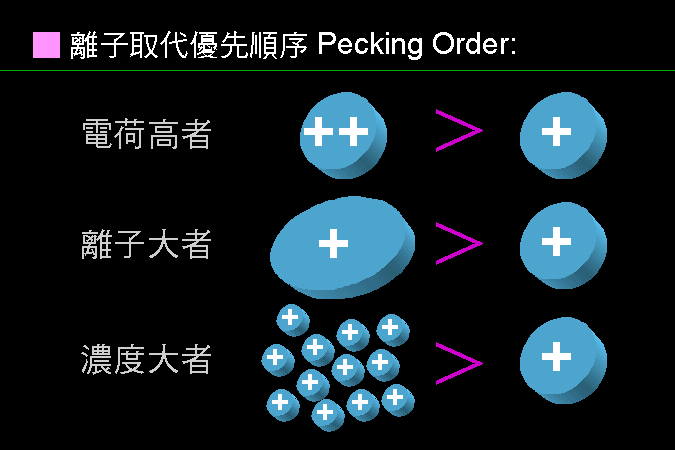
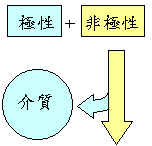
這種親和力的產生,決定於樣本或兩相物質之化學本質,是屬極性或非極性,而遵循『Like dissolves like』的原則;即極性分子易溶入極性的固定相或流動相,非極性分子則易溶入非極性者;一個樣本分子,則依其極性大小在此兩相間做選擇。 |
|
|||||||||||
|
c. 方式很多 |
因固定相或流動相可能是 固 (S)、液 (L) 或 氣 (G) 相之一,故有多種方式: |
||||||||||||
|
chromatography: |
固定相 (L) 流動相 (L) |
例: PPC, TLC, 膠体過濾 |
|||||||||||
|
Adsorption chromatography: |
固定相 (S) 流動相 (L) |
例: TLC, 離子交換 |
|||||||||||
|
Gas-liquid chromatography: |
固定相 (L) 流動相 (G) |
例: GC |
|||||||||||
|
d. 常用的層析方法 |
表 3.1 各種大小分子的色析法應用:
|
||||||||||||
|
◆ 我們只討論大分子的層析法 |
|||||||||||||
|
TOP ▲ |
|||||||||||||