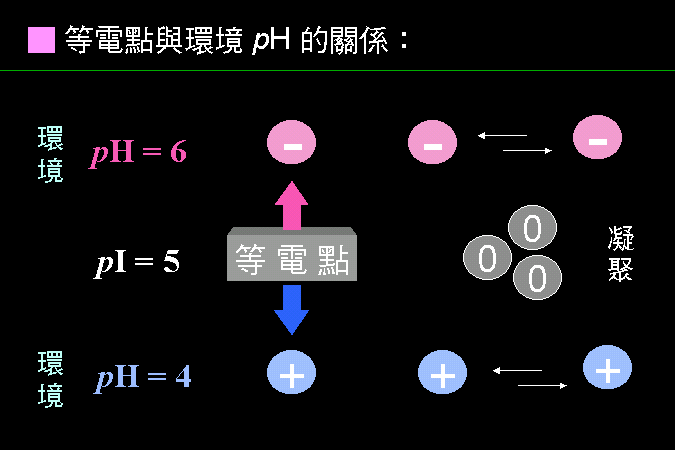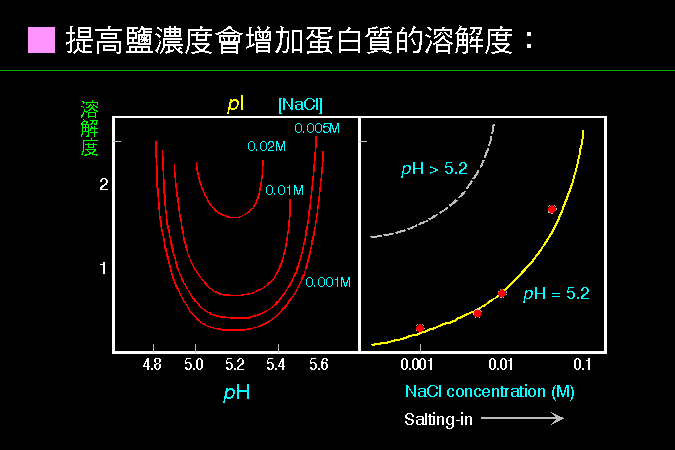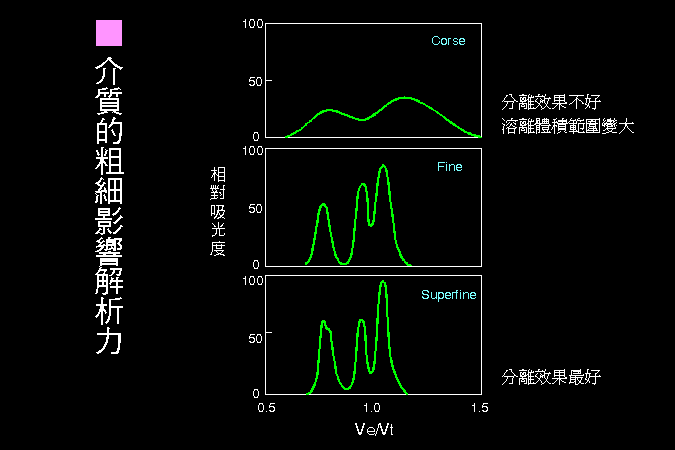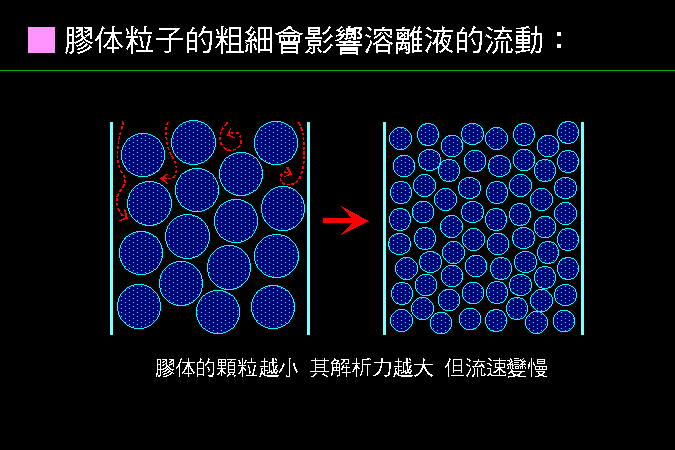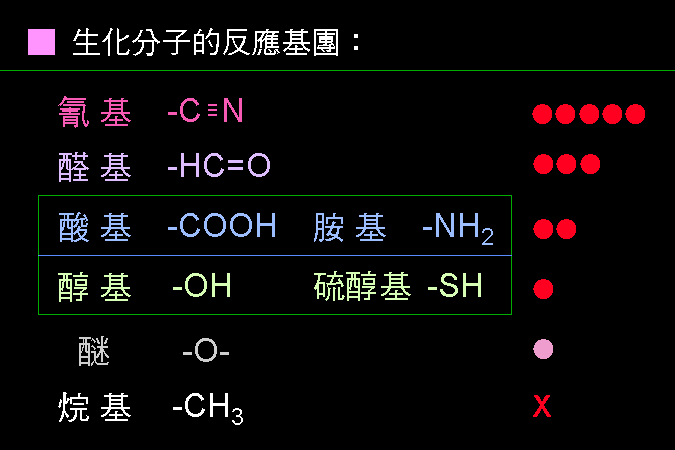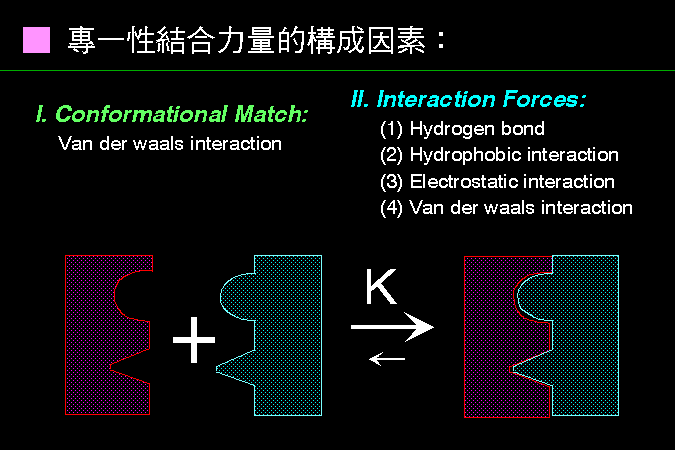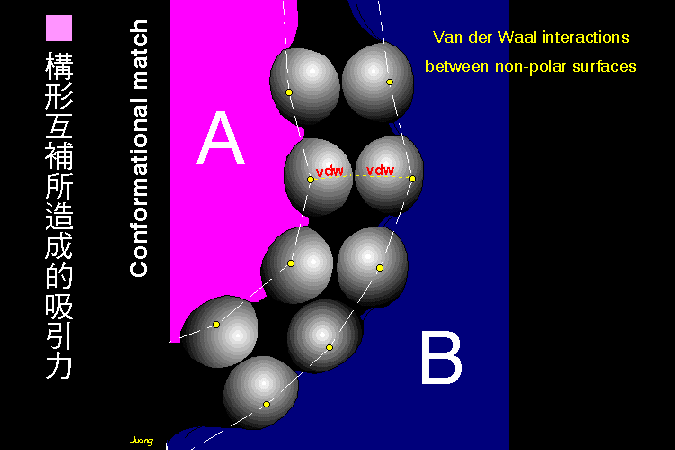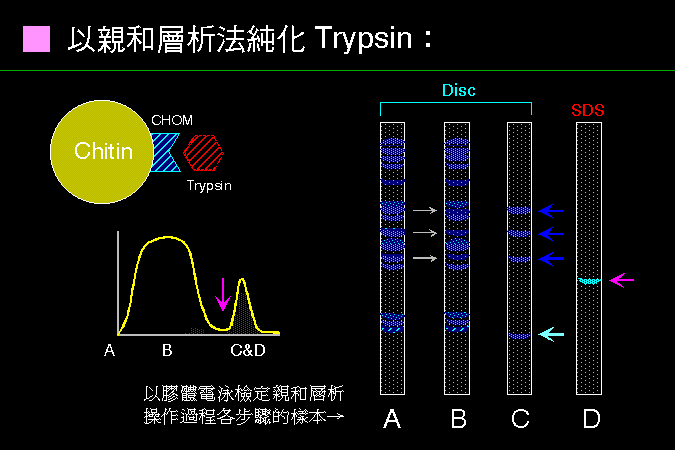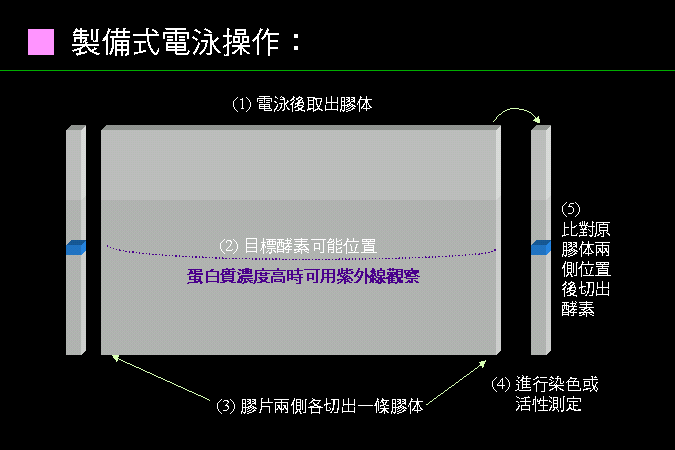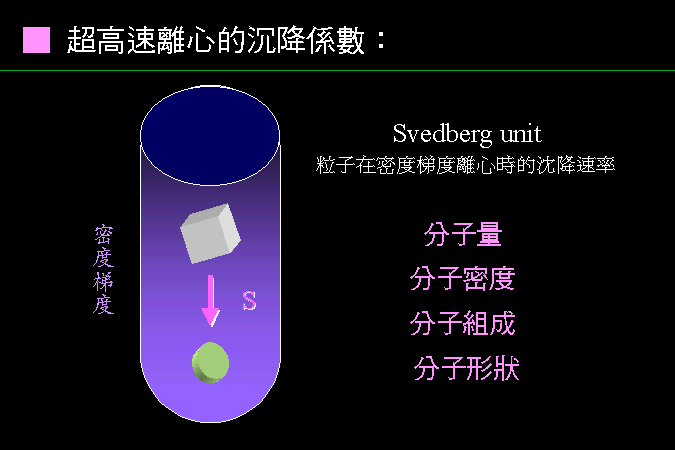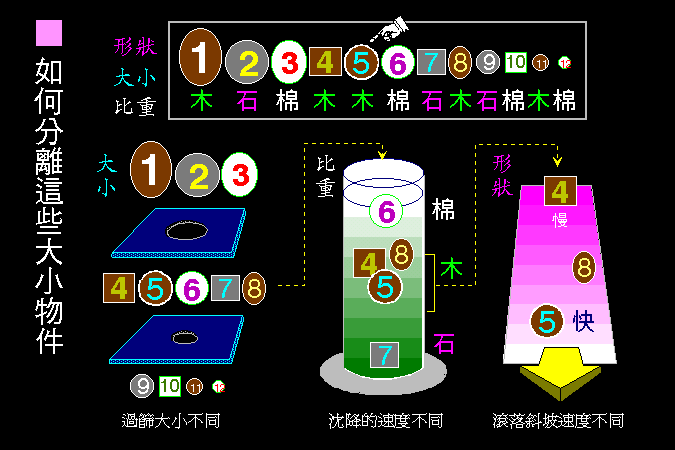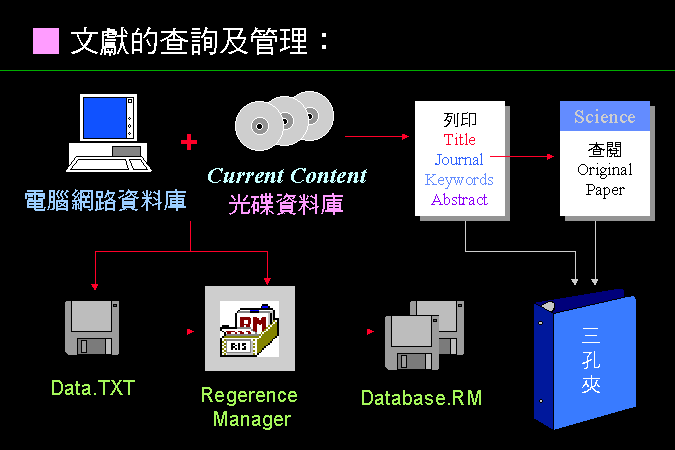
科學文獻的 查詢 與 存取,因為電腦及軟體的應用,變得非常有效而且有趣。
電腦在文獻管理上的進步速度非常快速,而且越來越方便。目前已經能夠在電腦上隨時查到即期的重要期刊文獻,而且由於 Acrobat 溜覽器的引入,馬上可以在螢幕上看到與紙本期刊完全一樣的內容,列印出來的品質也相當真實。
同時,個人資料庫 的建立,也有許多好用的軟體。例如,Reference Manager 或 EndNote 可以把你所找到的文獻,自動輸入你的個人資料庫,然後在你寫論文的時候,把所引用的文獻一一插入,並且以所要發表期刊的格式自動列出 reference list。
查資料時,網站的利用是極為重要的事;請把網站搜尋的本事練好,上網搜尋看似簡單,事實上需要一點尋寶的能力與經驗,隨便亂逛可找不到好東西。以下是一些有用的網站,有空請進入一覽,必能有所收穫。
◆ 生化科學 http://biochemlinks.com/
◆ 生物技術 http://www.accessexcellence.org/
◆ 生物技術教育 http://www.ncbe.reading.ac.uk/
◆ 化學連結 http://www.shef.ac.uk/~chem/chemdex/
XP1100a2