2 蛋白質抽取︰
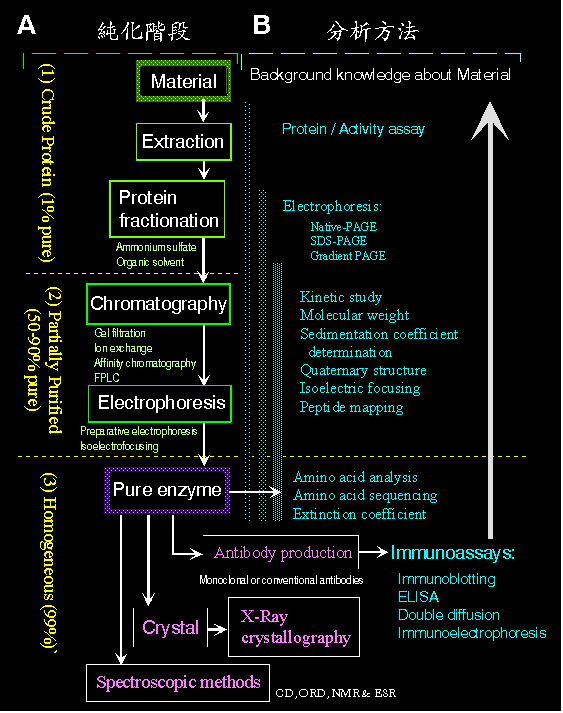
酵素的純化過程,約可分為三個階段:
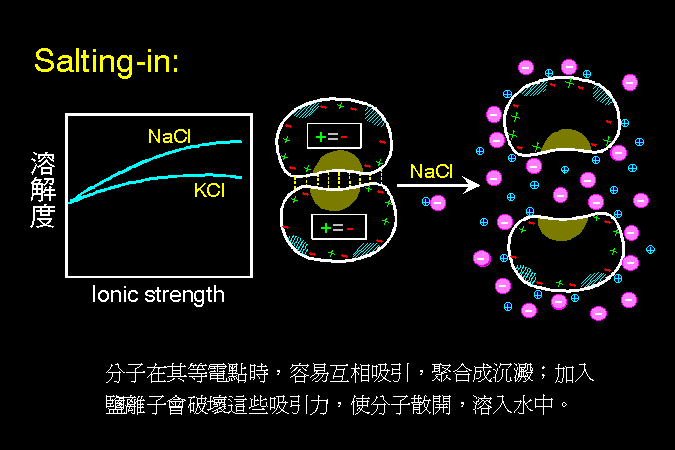
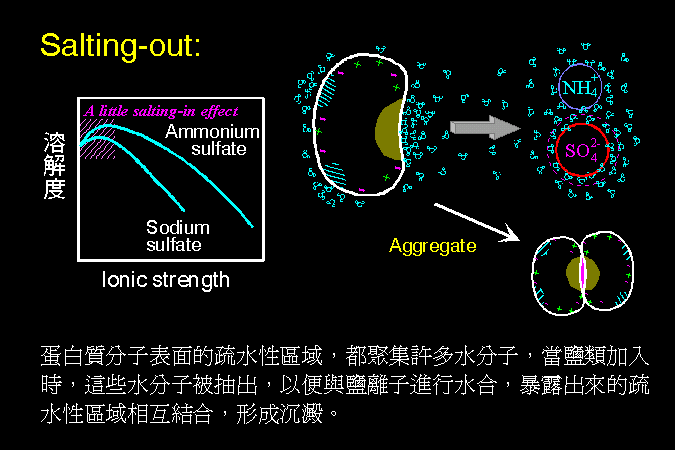
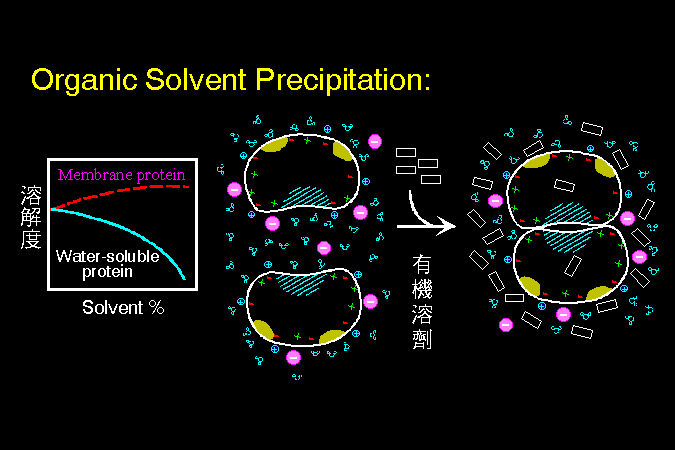
(1) 粗蛋白質 (crude protein)︰ 採樣 → 均質打破細胞 → 抽出全蛋白,多使用 鹽析沉澱法;可以粗略去除蛋白質以外的物質。
(2) 部分純化 (partially purified)︰ 初步的純化,使用各種 管柱層析法。
(3) 均質酵素 (homogeneous)︰ 目標酵素的進一步精製純化,可用 製備式電泳 或 HPLC。
圖 2.1 列出其相關的純化及分析方法。
圖 2.1 酵素純化階段與各種分析方法
■ 各種純化與分析方法 ■ 自行組合各種純化方法