|
4.2 超高速離心法: |
TOP ▲ |
|
|
a. 沉降係數 |
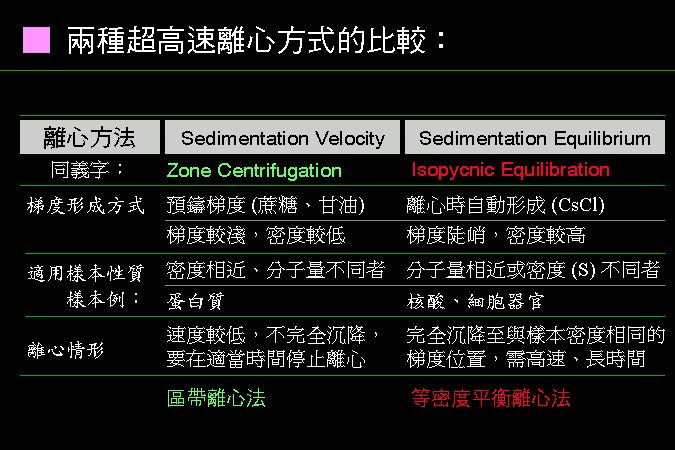
蛋白質分子在離心時,其 分子量、分子密度、組成、形狀 等,均會影響其沉降速率,沉降係數 即用來描述此沉降性質; 其單位為 S (Svedberg unit),每一種蛋白質的沉降係數與其分子密度或分子量成正比。 不同沉降係數的蛋白質,可利用超高速離心法,在密度梯度中作分離。 |
|
|
b. 密度梯度作法 |
一般有三種製作梯度的方式: (1) 在樣本溶液中直接溶入 CsCl,經離心後自動形成梯度。 (2) 使用梯度製造器,在離心管內預先拉好 甘油 或 蔗糖 的梯度,加樣本後離心。 (3) 在一極為熟悉的離心操作中,以上亦可以 階段式 (stepwise) 梯度進行。 |
|
|
c. 兩種離心方式 |
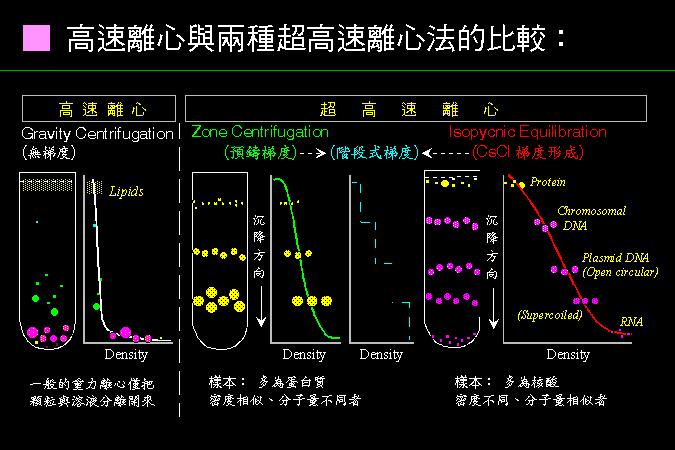
上述 (1) 及 (2) 二者,分屬兩類不同的離心形式,列表並以圖解說明如下︰ |
|
|
表 4.1 兩種超高速離心方式的比較: |
||
|
|
||
|
|
||
|
圖 4.1 高速離心與兩種超高速離心法的比較 |
||
|
d. 離心陀種類 |
使用不同離心陀,有不同離心方式及效果。 (1) 角型 (angle rotor): 典型的離心方式,多用在大量製備時。 (2) 懸籃式 (swing bucket rotor): 傳統用在密度梯度離心。 (3) 垂直 (vertical rotor): 取代懸籃式,可大大縮短離心時間。 (4) 區帶 (zonal rotor): 在梯度離心後,可直接分劃出各區帶樣本。 (5) 連續式 (continuous rotor): 可一邊離心,一邊加入或取出樣本。 |
|
|
e. 操作注意 |
超高速離心因為轉速極高,離心陀構造也較複雜,操作上要非常小心,完全純熟後才進行實驗,新手要有熟練者在旁指導。 操作時特別注意下列各點: (1) 離心管的平衡要準確,封管要確實,否則液体可能被抽乾。 (2) 使用懸籃式離心陀,在懸掛離心管時,要注意有沒有掛妥。 (3) 轉速切勿超過所使用離心陀的最高限,老舊者的最高限還要打折。 (4) 離心後要清理離心陀,可用水沖乾淨後晾乾;尤其使用 CsCl 者,非洗不可。 (5) 時常檢查離心艙及離心陀,注意有無腐蝕及傷痕,有者立刻請廠商檢修。 |
|
|
TOP ▲ |
||