|
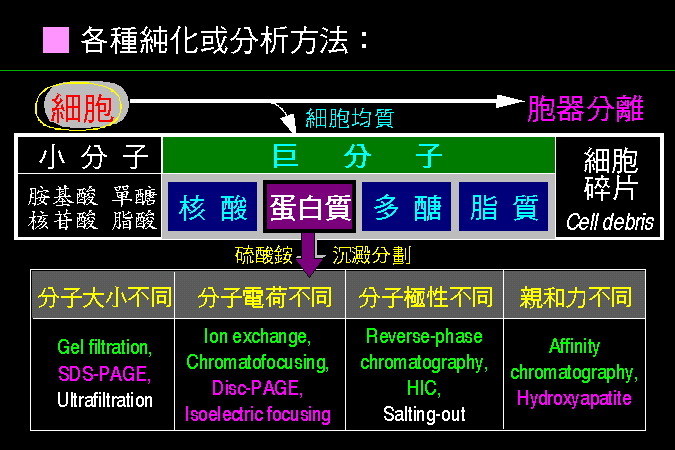
5 純化策略︰ |
|||
|
正確的純化策略極為重要,往往可以使純化達事半功倍之效,因此事前要有極為充分的準備與規劃過程。 但有時對目標酵素所知甚少,就要一步一步去試,可說是摸著石頭過河;此時,要小心追蹤每一個步驟到底回收多少酵素活性? |
|||
|
5.1 純化步驟設計: |
TOP ▲ |
||
|
影響純化的因素 |
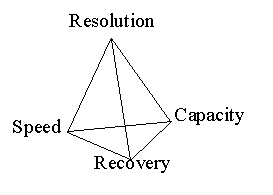
設計純化步驟時,需考慮下列各項要求;右圖則是 Pharmacia 操作手冊所建議的四種考慮因素。 |
|
|
|
a. 高活性 |
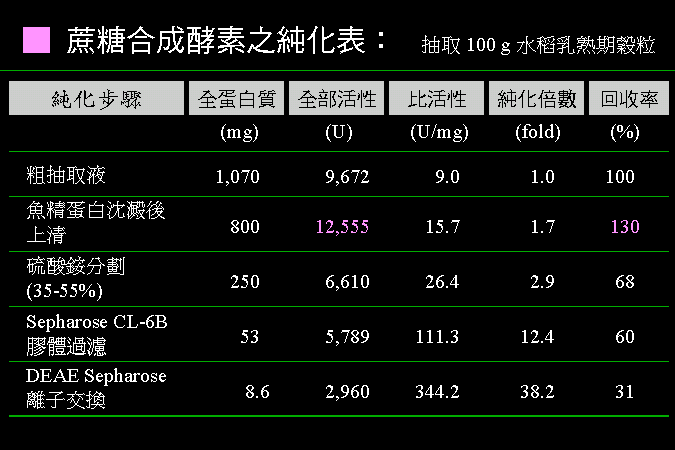
酵素的 比活性 要能顯著提高,純化成品與原始粗抽液二者間,其比活性之比值稱為 純化倍率 (purification fold);各種酵素因材料來源及含量多寡不一,純化倍率也有高低;不過就同一樣本而言,當然越高越好。 |
||
|
b. 高回收率 |
一般指總活性的回收,最終回收率低於 30% 就得檢討過程是否有大問題。 |
||
|
c. 高純度 |
純度 與 活性 是酵素純化的兩大目的,以達到均質酵素為最終目標;相對而言,在電泳上看不到其它雜質,即可視為均質,但也只能說是 elctrophoretically pure;但絕對均質的酵素幾乎是不可能得到,我們只能達到相對純度者。 |
||
|
d. 方便與快速 |
方法要儘量簡便,步驟勿拖太久,因為酵素活性可能隨著時間而急速降低;對較不穩定的酵素,時間是最重要因素,有時不得不犧牲其它要求。 |
||
|
e. 經濟 |
許多試劑相當昂貴 (尤其是活性分析用藥),大量使用時要考慮經濟問題。 |
||