|
2 酵素活性測定法︰ |
||
|
2.1 催化反應: |
TOP ▲ |
|
|
a. 反應設計原則 |
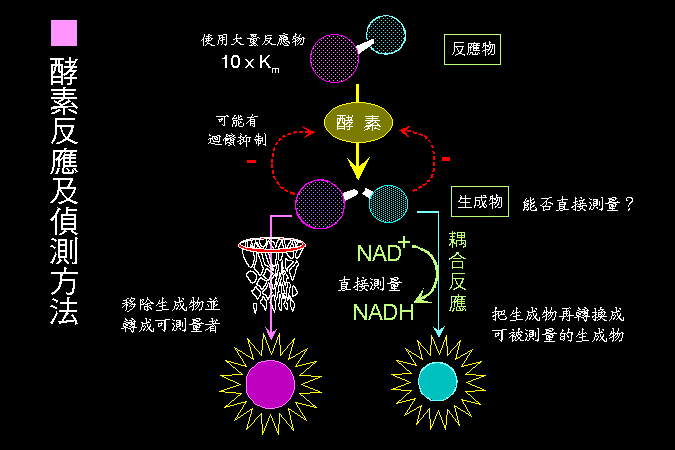
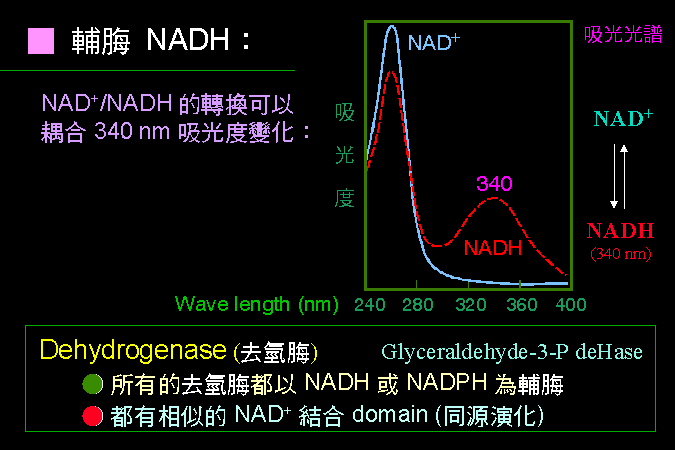
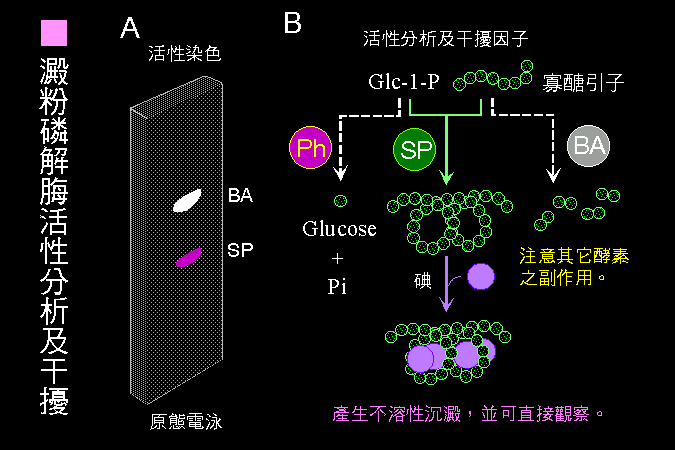
大部分酵素反應方式,都可包括在圖 2.1 的大綱中;建立酵素活性測定步驟時,請注意以下原則︰ (1) 測定 生成物的產生量,比測基質 (反應物) 的消失量,更方便且靈敏;儘量避免測定生成物。 (2) 反應流程儘量 簡單,太複雜的操作過程,增加工作量及成本,且容易造成失誤。 (3) 複雜的反應,可能產生某些意外的生成物 (或 pH 改變),回饋抑制 酵素反應 (以負號表示)。 (4) 反應條件要有利於指定 反應方向 的進行,可以移除生成物 (以籃框表示),或接上耦合反應。 (5) 小心樣本中有無其他酵素 (或抑制劑) 干擾,會因為消耗反應物或生成物,而加強或減弱目標酵素的活性,造成假象。 |
|
|
|
||
|
圖 2.1 酵素活性分析及偵測原則 |
||
|
b. 反應基質及酵素濃度 |
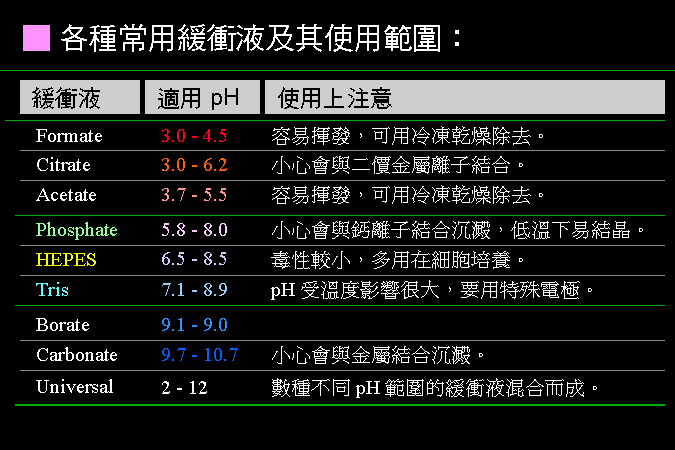
在試管中進行的酵素活性分析,與在生物体內的酵素反應,有相當的差距;為使反應達最大活性 (Vmax),或往指定方向進行,所使用基質濃度為十倍 Km。 反應的最適 pH、溫度、時間等條件,均需以實驗求得;尤其酵素的用量影響結果甚鉅,要事先找出最適當的使用濃度。 |
|
|
TOP ▲ |
||