|
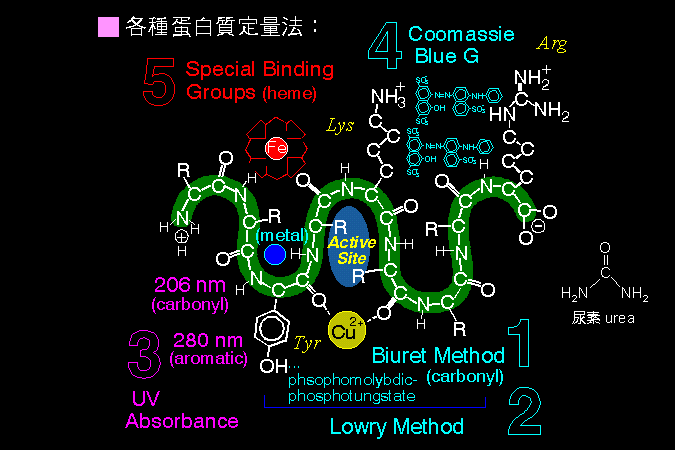
圖 1.1 各種蛋白質定量方法所依據的原理 ■ 比較蛋白質染色法 |
|
目標蛋白質在中央以捲繞的粗線表示,其上並標出蛋白質的脊骨 (-N-C-C-N-C-C-),連同胺基酸上的各種官能基團 (Lys, Arg, Tyr 等),都可被利用來作為定量之用。 |
|
TOP ▲ |