酵素化學實驗中,兩種最基本的分析方法,就是蛋白質定量,以及該酵素的專一性催化反應。本實驗課程從頭到尾都要用到這兩種分析方法,請自琢磨出精準的定量技術。
以 96 孔的微量滴定盤,進行蛋白質的定量;有以下兩種常用的方法。
1.1.1 Bradford 定量法:
Bradford 法是利用蛋白質與 Coomassie Brilliant Blue G-250 結合呈色來定量。
儀器:
37℃ 恆溫箱
ELISA 光度計 (Dynatech MR 5000)
試劑用具:
50 mM Tris buffer, pH 7.4 (Buffer A)
蛋白質標準品 (bovine serum albumin, BSA, 100 mg/mL)
未知樣本 (含未知濃度的蛋白質)
大頭針或噴火槍
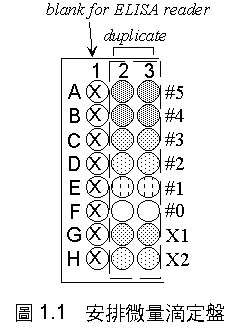
先準備一組系列 BSA 標準品:
|
Label |
BSA (mL) |
Buffer A (mL) |
最終濃度
(mg/mL) |
操作注意 |
|
#5 |
500 |
0 |
100 |
混合均勻 |
|
#4 |
400 |
100 |
80 |
混合均勻 |
|
#3 |
300 |
200 |
60 |
混合均勻 |
|
#2 |
200 |
300 |
40 |
混合均勻 |
|
#1 |
100 |
400 |
20 |
混合均勻 |
|
#0 |
0 |
500 |
0 |
混合均勻 |
並以未知樣本準備數種濃度的未知樣本 (X1, X2 …)
方法:
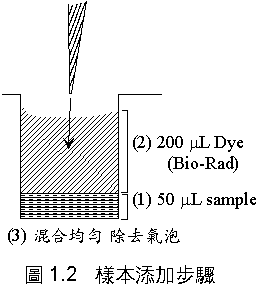
(1) 每槽取 50 mL 標準品 (#0, #1 .... #5) 或未知樣本 (X1, X2),以二重複加入 96 孔微量滴定盤中。
(2) 每槽再加 200 mL dye (1/4×),在全部樣本槽加完前,不要中斷添加;整個操作時間不要拖太久,同時小心避免氣泡產生。
◆ 本步驟是實驗成敗的關鍵!
(3) 輕拍滴定盤的一側,使添加的各成份均勻混合,注意 Dye Reagent 因密度較大,很容易沉積在下方。
圖 1.2 顯示這三個連續動作 (1)→(2)→(3)。
◆ 這時若還有氣泡,小心用大頭針刺破,大量時可用火燄燒破之。
(4) 靜置室溫 10 min。
(5) 以 ELISA reader 測 570 nm (或 595 nm) 吸光。
(6) 作圖畫出標準校正線,並決定未知樣本的濃度。
1.1.2 BCA 定量法:
BCA (bicinchoninic acid) 法是利用蛋白質對兩價銅離子 (Cu2+) 進行還原,所生成的 Cu+ 可以 BCA 專一性地呈色而定量。
儀器:
儀器用具 同上
試劑用具:
一般緩衝液同上,另需下列物品:
BCA reagent kit (Pierce 23225):含 Reagent A (BCA) 及 Reagent B (CuSO4)
事先將 Reagent A 和 Reagent B 以 50:1 比例均勻混合,每盤要 20 mL。
先準備一組系列 BSA 標準品 (BSA 2 mg/mL):
以 Tris 稀釋成一系列濃度:2000, 1000, 500, 250, 125, 62.5, 31.25 mg/mL
方法:
(1) 在一微量滴定盤上,各標準品每濃度取 20 mL 以二重複加入預定槽內。
(2) 每槽加 200 mL 上述之混合 Reagent,全部樣本槽加完前不要中斷。
◆ 所有操作之注意要點同上。
(3) 輕拍滴定盤的一側,使添加的各個成份均勻混合。
(4) 靜置 37℃ 反應 10 min。
(5) 以 ELISA reader 測 562 nm (或 570 nm) 吸光。
(6) 作圖畫出標準校正線,並決定未知樣本的濃度。