|
B3-2
|
|
|
|
|

|
|
酵素化學實驗 B3
酵素操作方法 1
分析 2 純化
3 電泳 4
轉印 |
|
|
到目錄 |
2 |
澱粉磷解脢純化方法
2.1 2.2
2.3 2.4 |
|
|
B3
目錄
|
|
|
|
|
|
|
澱粉磷解脢的純化方法,主要依循張長泉在
1987 所發表論文之步驟
(Agric. Biol. Chem. 51: 187-195)。 材料甘藷 (Ipomoea batatas)
為台農 57 號成熟新鮮塊根,購自一般市場;台農 57
號是在民國 49 年利用台農 27 號甘藷為母本,與 Nancy Hall
為父本雜交育成。一般的純化過程,通常是先以 硫酸銨分劃
出蛋白質,再以 膠體過濾 或 離子交換
層析法分離;也可進一步使用 製備式電泳,直接割出所要的蛋白質色帶。
|
|
|
|
|
|
|
|
|
2.1 |
粗抽取及硫酸銨分劃: |
▲ |
|
|
|
|
|
|
|
|
儀器: |
|
|
|
|
製簽用具、果汁機或均質機、紗布
|
|
|
|
|
高速冷凍離心機
|
|
|
|
|
透析袋
及攪拌器 |
|
|
|
|
|
|
|
|
|
試劑用具: |
|
|
|
|
緩衝液
A (5
× stock): |
|
|
|
|
|
Tris (50 mM
× 5) |
(BDH 10315P)
|
30.3 |
g |
|
|
|
加水 800 mL 溶解,以 6 N HCl 調整 pH 成為 7.4
後,加水至 1 L。使用時加水稀釋 5 倍,並加入 b-mercaptoethanol
(Sigma) 使其最終濃度為 1 mM。 |
|
(Tris = Tris [hydroxymethyl]methylamine, 其 pH
受溫度的影響很大) |
|
|
|
|
|
|
|
|
|
|
緩衝液
B: |
|
|
|
|
緩衝液
A 再加入 1% (w/v) polyvinylpolypyrrolidone, PVP (Sigma)。 |
|
|
|
|
|
|
|
|
|
緩衝液
C: |
|
|
|
|
緩衝液
A 再加入 NaCl 成為 0.15 M 濃度。
|
|
|
|
|
|
|
|
|
|
硫酸銨
(ammonium sulfate): |
|
|
|
|
硫酸銨
(Merck 101211)
於烘乾去除水分後,直接使用於蛋白質鹽析法。
|
|
|
|
|
|
|
|
|
|
方法: |
|
|
|
|
(1)
取新鮮甘藷塊根,洗淨後去皮,製簽後約重 100 g,加入
150 mL 冰冷緩衝液 B,使用果汁機在 4℃
下均質,高速攪拌 1 min,停止冷卻 1 min,重複 5 次。 |
|
|
|
|
(2)
均質液以四層紗布過濾,取濾液離心 30 min (Hitachi RPR-12,
8,000 rpm);收集上清液即得粗抽取液 (XT),測量其體積,記得要留
0.1 mL 做為樣本。 |
|
|
|
|
◆
各種離心機之性能各有不同,請自行調整適當的時間及轉速。 |
|
|
|
|
(3)
取上清液於冰浴下緩緩加入硫酸銨,並不時攪拌,達到所要的飽和度
(如 20%),所加的重量要查表 (表 2.1);繼續攪拌平衡 10
min 後,離心 30 min 同上。 |
|
|
|
|
(4)
收集沈澱,溶在最少體積的緩衝液 A,並測量其最終體積若干。同時測量上清液體積,繼續以硫酸銨沈澱之,加到下一個飽和濃度
(如 40%)。 |
|
|
|
|
(5)
如此重複收集各分劃,共有五個沈澱,如上述分別以緩衝液
A 溶解後,分置於五個透析袋中,對緩衝液 C
透析過夜;次日同上離心 30 min 後取上清液。 |
|
|
|
|
(6)
分析活性後,取總活性最高的一個或數個分劃,集中得到粗抽蛋白質
(AS)。
|
|
|
|
|
|
|
|
|
|
表
2.1 各百分飽和濃度硫酸銨添加量
|
|
|
|
|
|
|
|

|
|
酵素化學實驗 B3
酵素操作方法 1
分析 2 純化
3 電泳 4
轉印 |
|
|
到目錄
|
2.2 |
膠體過濾法: |
▲ |
|
B3
目錄
|
|
|
|
|
|
|
膠體過濾法
是依據樣本分子的大小差異來進行分離的,本實驗使用
Sephacryl S-300
作為分離介質,對大部分的蛋白質均適用,但要提高鹽濃度以克服其吸附力。
|
|
|
|
|
|
|
|
|
|
|
儀器: |
|
|
|
|
層析管柱
(Pharmacia
C16 column, 100 cm) 最好附有 adapter (AC16)
|
|
|
|
|
蠕動幫浦
(Pharmacia peristaltic pump
P-1) |
|
|
|
|
分劃收集器
(fraction collector, Gilson 或
Pharmacia) |
|
|
|
|
細胞離心機、Centriprep
(Amicon) |
|
|
|
|
|
|
|
|
|
試劑: |
|
|
|
|
Sephacryl
S-300 (Pharmacia
17-0599-01) |
|
|
|
|
緩衝液
C (緩衝液 A 再加有 0.15 M NaCl) |
|
|
|
|
|
|
|
|
|
方法: |
|
|
|
|
管柱裝填: |
|
|
|
|
(1)
預先將管柱洗淨、晾乾後備用,也要熟悉整隻管柱的拆裝方法。 |
|
|
|
|
(2)
架起管柱,以水平儀調整管柱,使之與地面垂直。 |
|
|
|
|
(3)
於管柱中加入約一半高度的緩衝液 C,測試管柱是否有漏水現象;若沒有漏水,則讓緩衝液流出,只留約
5 cm 高的緩衝液 C;以塞子暫時堵住下方出口。 |
|
|
|
|
(4)
取出所要使用的膠體,好除去所含的 20%
酒精,並平衡在緩衝液 C
中;膠體的處理方法,請參閱講義 B2 酵素純化方法
3.2.4。 |
|
|
|
|
◆
若是在室溫中進行層析法,一定要等膠體的溫度完全回復室溫才可裝填。 |
|
|
|
|
(5)
將所要裝填之膠體搖盪均勻,不要有未散之硬塊,也避免氣泡產生,若有氣泡產生則以超音波震盪器
(sonicator) 趕出,並以抽氣去除之。 |
|
|
|
|
(6)
將上述混合均勻之膠體,以玻棒沿管壁流暢倒入管柱,並且避免使得氣泡陷在膠柱中;可在裝填後,以手電筒在膠柱後方打燈光檢查之。 |
|
|
|
|
(7)
利用重力自然沈降 1~2 min
後,移去管柱下方軟管的塞子,利用流速加快沈降,注意不可使管柱上方的液相完全乾去。 |
|
|
|
|
(8)
待膠體已沈降完全,用塞子止住下方軟管,並且以緩衝液加滿管柱。 |
|
|
|
|
(9)
取出管柱的 adapter
並接好軟管及蠕動幫浦管路,並使整個幫浦及軟管內,完全充滿緩衝液,不得有任何氣泡陷在裡面。 |
|
|
|
|
(10)
小心將 adapter
放入管柱內,往下推至膠面上方,檢查有無氣泡留滯在
adapter 下面,然後鎖緊 O-ring。此時 adapter
與膠面間有一小段充滿緩衝液的空間。 |
|
|
|
|
(11)
移去管柱下方軟管的塞子,用幫浦注入緩衝液 C
流洗兩個管柱體積。 |
|
|
|
|
(12)
暫時停止幫浦輸送,用塞子止住下方軟管,放鬆幫浦使管路呈流通狀態,稍微旋開
adapter 的 O-ring,將 adapter
緩慢往下壓,液體會從幫浦上端軟管流回去,當壓至膠面時,即旋緊
O-ring,鎖上幫浦門,並移去管柱下方軟管的塞子。 |
|
|
|
|
(13)
緩衝液 C 以預定流速之 150% 流速流 (約 45 mL/h)
洗膠體;一般而言,膠體過濾膠體流洗 1~2
管柱體積,其它膠體約 3~5 體積。 |
|
|
|
|
(14)
檢查膠面是否因高壓流洗而下降,若降低則重複步驟
(12) 把 adapter 往下壓。 |
|
|
|
|
|
|
|
|
|
層析操作: |
|
|
|
|
(1)
取樣本以幫浦注入管柱,膠體過濾法的樣本體積約為膠體體積的
3%
以內;注意樣本的溫度與膠體不能相差太多。 |
|
|
|
|
◆
樣本體積不能太大,因此要先以 Centriprep
離心濃縮之;濃縮後之 Centriprep 要保存在 20%
酒精中,下次使用前要先洗去酒精。 |
|
|
|
|
(2)
在注入樣本後,以預定流速進行溶離,膠體過濾層析法即開始進行,要馬上啟動分劃收集器;所有溶離物質,應在大約
1.5 倍管柱體積之內流出。 |
|
|
|
|
(3)
收集所得的樣本可進行蛋白質定量及活性分析,收集具有高活性的蛋白質峰,保存部分樣本後,進行下一個純化步驟。 |
|
|
|
|
|
|
|
|
|
原態分子量測定: |
|
|
|
|
(1)
膠體過濾管柱可做為原態分子量測定之用,但須以標準蛋白質做好校正曲線。 |
|
|
|
|
◆
標準蛋白質 (Bio-Rad
151-1901): Thyroglobulin (670); bovine gamma
globulin (158); chicken ovalbumin (44); equine myoglobin (17); vitamin
B-12 (1.35) kD |
|
|
|
|
(2)
同時也要把純質的目標酵素加入標準蛋白質中,一起進行膠體過濾。 |
|
|
|
|
◆
你目前的澱粉磷解脢含有大量雜質,通常無法做為目標酵素樣本,因此須由助教供應較純質的澱粉磷解脢。 |
|
|
|
|
(3)
跑完膠體過濾後,測定蛋白質以找出各標準蛋白質峰,並測定酵素活性峰,決定目標酵素的溶離位置,以內插求出澱粉磷解脢的分子量。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
酵素化學實驗 B3
酵素操作方法 1
分析 2 純化
3 電泳 4
轉印 |
|
|
到目錄
|
2.3 |
離子交換法: |
▲ |
|
B3
目錄
|
|
|
|
|
|
|
DEAE
(diethylaminoethyl) 是一種
陰離子交換
基團,通常也使用聚醣類為固相介質。
|
|
|
|
|
|
|
|
|
|
儀器: |
|
|
|
|
|
層析管柱
(Pharmacia
C26
× 40) 需附有 adapter (AC26)
|
|
|
|
|
蠕動幫浦
(Pharmacia peristaltic pump
P-1) |
|
|
|
|
分劃收集器
(fraction collector, Gilson
或 Pharmacia) |
|
|
|
|
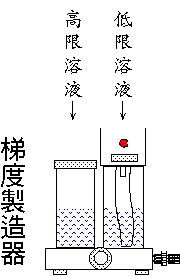
梯度製造器
(Pharmacia
gradient mixer
MX-1) |
|
|
|
|
|
|
|
|
|
試劑: |
|
|
|
|
DEAE
Sephacel (Pharmacia
17-0500-01; DEAE
Sepharose)
|
|
|
|
|
緩衝液
A、緩衝液 C 及固体 NaCl |
|
|
|
|
|
|
|
|
|
方法: |
|
|
|
|
(1)
DEAE Sephacel
的裝填方法大致同膠體過濾法,裝填於較為粗短的管柱中
(C26 × 40),膠體體積約為 50 mL,並以緩衝液 C
流洗,使平衡至 pH 為 7.4。 |
|
|
|
|
◆
DEAE 膠體最好在管柱外先以緩衝液 C 徹底平衡好,再生一定要完全! |
|
|
|
|
(2)
將來自膠體過濾的樣本,注入管柱之後以緩衝液 C
流洗兩個管柱體積,此時不應有蛋白質流洗出;但流出液也應加以收集,以免因失誤而損失。 |
|
|
|
|
(3)
在緩衝液 A 中加入 NaCl 使其濃度達 0.5 M,成為高限流洗液;而緩衝液
C 中已具有 0.15 M NaCl,為低限流洗液。 |
|
|
|
|
(4)
在梯度製造器的兩端,各加入高低限鹽溶液 250 mL,與幫浦連線,進行梯度流洗,同時也啟動分劃收集器,每
5 mL 收集一管。 |
|
|
|
|
◆
注意低限溶液是加在靠近管柱那一邊,添加時兩邊暫時不要流通。 |
|
|
|
|
(5)
待梯度製造器中的溶液用盡,加入 100 mL
高限流洗液,洗出殘餘蛋白質。 |
|
|
|
|
(6)
收集 L-SP 活性區,濃縮後以便繼續進行純化步驟。 |
|
|
|
|
|
|
|
|
|
沒有梯度製造器時: |
|
|
|
|
(1)
梯度製造器相當昂貴,若無法購置,也可使用階段式梯度;每次用一個鹽濃度流洗一個管柱體積,漸漸提高濃度,如
0.2 M → 0.3 M → 0.4 M → 0.5 M。 |
|
|
|
|
◆
各種濃度的溶離液是用緩衝液 A 加上適量 NaCl
配置而得。 |
|
|
|
|
(2)
階段式梯度的效果,不見得比連續式梯度差,有時反而會有較佳分離效果。 |
|
|
|
|
(3)
自己製作一個梯度製造器也非難事,用兩個適當大小的塑膠針筒,及一個小型攪拌子即可作成;製作的詳細方法與圖示,可參閱莊榮輝博士論文
p. 65。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
酵素化學實驗 B3
酵素操作方法 1
分析 2 純化
3 電泳 4
轉印 |
|
|
到目錄
|
2.4 |
製備式電泳
與電泳溶離: |
▲ |
|
B3
目錄
|
|
|
|
|
|
|
利用原態膠體電泳可直接分離得蛋白質,並以電泳溶離回收該蛋白質。
雖然電泳解析力高,可快速分離所要的蛋白質,然而使用時仍有一些限制:
(1)
要能確認目標蛋白質在膠體上的位置,可使用活性染色 (如
SP); (2)
樣本濃度太低者不宜使用,因膠體溶離的回收過程會造成大量損失;
(3) 很多蛋白質在原態電泳有拖尾現象,不易定位回收 (如醣蛋白)。
|
|
|
|
|
|
|
|
|
|
儀器: |
|
|
|
|
電泳設備
(Hoefer SE-250 平板式垂直電泳槽)
|
|
|
|
|
間隔條
1.5 mm (不須使用樣本梳) |
|
|
|
|
溶離設備
(Little Blue Tank 電泳濃縮器 ISCO Model 1750) 附有 4 個溶離槽 |
|
|
|
|
解剖刀
(Feather No. 23) |
|
|
|
|
|
|
|
|
|
試劑: |
|
|
|
|
電泳膠體溶液的配置及鑄膠方法詳見
3.1 節
|
|
|
|
|
澱粉磷解脢的膠體活性染色試劑詳見
3.5.4 節 |
|
|
|
|
電泳溶離液
stock: 0.2 M Tris-acetate (pH 8.6) |
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
|
|
|
方法: |
|
|
|
|
電泳及切割膠片: |
|
|
|
|
(1)
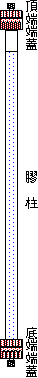
用 SE-250 鑄膠器以 1.5 mm 間隔條鑄造 6% native-PAGE;如圖
2.1
所示,其分離膠体只佔全高度一半,焦集膠体佔四分之一,則樣本佔其餘四分之一;不用樣本梳,只跑一種樣本。 |
|
|
|
|
(2)
經色析法純化所得 L-SP 樣本,先以限外過濾 (Centriprep
YM-30) 濃縮至 3 mL,再加入適量追蹤染料小心注入樣本槽,樣本槽約可容納
15 mL。 |
|
|
|
|
(3)
於 4℃ 冷房中進行,以定電壓 150 V 進行電泳約 1 h。 |
|
|
|
|
(4)
待染料跑出膠片外,停止電源拆開裝置。 |
|
|
|
|
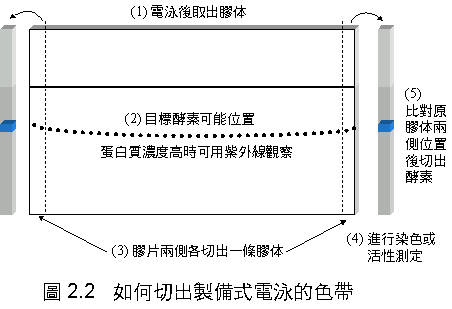
(5)
拆開膠片組合,用解剖刀在膠片左右兩側各切下一條膠體
(寬 0.2 cm) 進行活性染色以確定 L-SP 活性位置 (圖 2.2)。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
電泳溶離: |
|
|
|
|
(1)
配置電泳溶離液 (0.01 M Tris-acetate),置冷藏櫃中預冷。 |
|
|
|
|
(2)
按照溶離器 Little Blue Tank
的使用說明書,將溶離小槽裝置妥當,檢查有無漏水;在樣本小槽及溶離大槽各倒入
0.01 M 溶離緩衝液。 |
|
|
|
|
(3)
將切割下的 L-SP 活性膠體切成 0.5 × 0.5 cm
的小塊,放入樣本小槽中,開始電泳溶離;應在冷藏櫃中進行溶離。 |
|
|
|
|
(4)
以等電流方式溶離 (10 mA),一次溶離約 2 h,取樣時暫時停止電流。 |
|
|
|
|
(5)
將塑膠吸管前端套上 Tycon tube (可避免刺破樣本小槽內的透析膜),伸入樣本小槽中,小心吸取靠近正極一側底部
100~200 mL 的溶液; 連續收集約 3~5
次可回收大部分在膠體中的 L-SP。取樣後,要小心回復原狀,繼續電泳溶離。 |
|
|
|
|
(6)
將溶離小槽中的膠體取一小塊進行活性染色,若無 L-SP
活性則可停止溶離。 |
|
|
|
|
◆
電泳溶離時不可過熱,以免使酵素失活;也可能因溶離或收集不當而失去酵素。電泳溶離槽的詳細構造,可參閱莊榮輝博士論文
p. 59。 |
|
|
|
|
|
|
|
|
|
|
|


