圖 1 酵素動力學公式的推演及其應用
|
Biochemistry Basics |
|
|
本網頁一律以『脢』表示 enzyme |
|
|
酵素動力學: |
|
|
|
以動力學說明酵素對基質分子的催化行為。 |
|
■ 目錄 第 3 節 酵素動力學 (討論汽車的速度與汽油的效率) |
|
|
■ 何為動力學? (酵素的效率決定於基質的濃度) |
|
|
◆ An Introduction to Enzyme Kinetics (英國 Paisley 大學的教學講義) |
|
|
酵素催化反應: |
|
|
|
|
|
■ 3.1 酵素的催化反應 (提供一催化表面 - 輔助桌面) |
|
|
|
|
|
a. |
反應物 (A, B) 轉變成生成物 (A-B) 途中,有 過渡狀態 [A...B] 生成: |
|
|
A + B → [A...B] → A-B |
|
b. |
過渡狀態 (transition state) 的位能較高,其生成需要能量,稱為 活化能 (activation energy, Eact);經由酵素的催化,可降低反應活化能,使反應速率加快,但 不影響反應的平衡方向。 |
|
c. |
一些過渡狀態的類似物 (analog) 會卡住酵素活性區,但無法完成反應,即成為抑制劑。 這種過渡狀態的類似物可做為抗原,免疫動物後所產生的抗體,可能有類似酵素的催化作用,但催化速率較低,稱為 abzyme。 |
|
|
■ Abzyme 催化性抗體 ([sp3]* 過度狀態) |
|
d. |
|
|
(1) 酵素活性區專一性地與基質結合,提供最適的空間排列,以便穩定過渡狀態。 |
|
|
(2) 活性區通常為一凹陷口袋,隔開外界的水環境,減低水分子的干擾。 |
|
|
(3) 活性區附近的某些胺基酸可提供 活性官能基 (通常帶有電荷) 直接參與反應。 |
|
|
(4) 很多酵素含有 輔脢 或 輔因子,輔助反應 (見上節)。 |
|
|
■ 3.1 酵素活性區 (魔術口袋) (穩定, 隔離, 基團, 輔脢) |
|
|
|
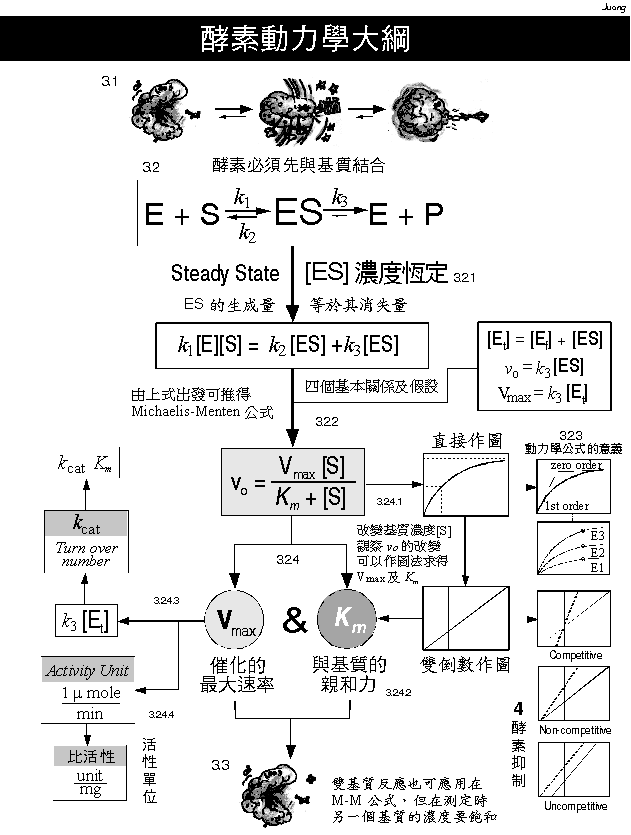
◆ 圖 1 酵素動力學大綱 是以流程方式,列出酵素動力學的主要探討項目。當研讀動力學部分時,請隨時依章節號碼參閱本圖。 (圖中酵素的漫畫造型取自 Gonick, L. & Wheelis, M. 所著 The Cartoon Guide to Genetics, 有中譯版) |
|
|
|
|
|
|
|
圖 1 酵素動力學公式的推演及其應用 |
|
|
酵素動力學: |
|
|
|
|
|
■ 3 酵素動力學 (考試評鑑:給予基質→看成效) |
|
|
基本概念: |
|
|
|
|
|
a. |
Steady state 理論: |
|
|
酵素催化時,基質先與酵素結合,生成過渡狀態,再轉變成產物; 而酵素與基質的結合是 可逆的 (E + S → ES); 而當反應達 穩定狀態 (steady state) 時,其中的 [ES] 濃度不變 (因為 ES 生成量等於其消失量)。 |
|
|
■ Invertase Reaction 轉化脢 (還原糖的測定法︰利用還原力) |
|
|
■ Steady State Theory 最重要基本假設 (有一 [ES] 濃度穩定狀態) |
|
b. |
酵素行為的數學描述: |
|
反應速率 (v) 與 酵素 或 基質 的關係,可以數學式表示; 在固定的酵素量下,反應速率 v 與基質濃度 [S] 成 雙曲線 關係 (但只有雙曲線一股),可用公式表之,即 Michaelis-Menten (M-M) 動力學公式。 |
|
|
◆ Stryer Biochemistry: Pre-Steady State Enzyme Kinetics (一套相當詳細的說明圖片) |
|
|
Michaelis-Menten 公式的推演: |
||
|
由四個基本設定開始,可一步一步推得 M-M 動力學公式。 |
||
|
a. |
酵素 E 與基質 S 反應如下,各步驟反應速率由常數 k1, k2, k3 表示: 基本式 |
|
|
|
|
|
|
b. |
導 M-M 公式前的四個基本關係及假設: 公設 |
|
|
|
(1) 因 [ES] 不變,故 ES 的消耗量等於生成量: |
|
|
|
k2 [ES] + k3 [ES] = k1 [E][S] |
(I) |
|
|
(2) 總酵素濃度 [Et] = 單獨存在者 [Ef] + 酵素基質複合體 [ES] [Et] = [Ef] + [ES] |
(II) |
|
|
(3) 反應初速 (vo) 是由後半分解反應 (k3) 所決定: vo = k3 [ES] |
(III) |
|
|
(4) 最大反應速率 (Vmax) 是假設所有酵素均轉變成 [ES], |
|
|
|
故上式可改寫為︰ Vmax = k3 [Et] |
(IV) |
|
|
■ 3.2.2 四個基本觀察式 (由基本式推 ES, Et, vo, Vmax) |
|
|
c. |
基於上述條件,可推 M-M 公式如下: |
|
|
|
||
|
Michaelis-Menten 公式的意義: |
||
|
M-M 公式可以求得 Vmax 及 Km,求得 Vmax 及 Km 有何意義? |
||
|
a.
|
M-M 公式是 雙曲線 公式。若固定酵素量,改變其基質量 [S],則可得到不同的反應初速 vo,再以 [S] 為 x 軸,vo 為 y 軸作圖,可得到一股雙曲線,其漸近點為 Vmax。 |
|
|
b.
|
低濃度 [S] 時反應速率 vo 與 [S] 成正比,即 vo∼[S] 1,是為 一級反應 (first order reaction); 當 [S] 增大,vo 接近漸近線時,vo 的改變很小,不受 [S] 變化的影響,即 vo∼[S] 0,稱為 零級反應 (zero order)。 |
|
|
c. |
若基質量 [S] 也固定,則 M-M 公式變為: |
|
|
Vmax (常數 [S]) vo = ────────── ∼ Vmax (常數) (常數 Km) + (常數 [S]) |
||
|
由 (IV) Vmax = k3 [Et],故 vo∼[Et],即 反應速率 與 酵素量 成正比。 |
||
|
d. |
事實上 ES → E + P 的反應為可逆,但此逆反應可忽略,因 M-M 公式的測定,是反應初期所測的反應初速 (vo),此時生成物 [P] 的濃度很低,逆反應幾乎無從發生。 |
|
|
|
◆ 練習以紙筆自行推演 M-M 公式及上述各種情況下的變化。 |
|
|
■ 動力學實驗的操作例子 (實驗也是如此操作) |
||
|
Vmax 及 Km 的測定與意義: |
|
|
Vmax 及 Km 是每一個酵素極重要的性質指標,可以顯示其催化特性。 |
|
|
■ 3.2.3 M-M 公式意義 → Km; Vmax (1st, 0 order 兩區;[S] 固定) |
|
|
Vmax 及 Km 測定法: |
||
|
步驟相當單純,但隨著各種酵素活性測定方法的難易有別。動力學實驗的基本資料,為在一系列 [S] 濃度下所測得的反應初速 (vo),依法作圖即可求出 Vmax 及 Km。 有以下數種作圖求法: |
||
|
a. |
直接作圖法: |
|
|
|
是最基本的數據作圖。 以 [S] 為橫軸 vo 為縱軸,所得漸近線的最高處為 Vmax,Km 為 50% Vmax 時的 [S]。 |
|
|
b. |
Lineweaver-Burk 雙倒數作圖法: |
|
|
|
是最常用的作圖方式;因直接作圖法只能以漸近估計求得 Vmax,若 x 及 y 軸分別改為 1/[S] 及 1/vo,則可作出一條直線來,由 x 軸上的交點求出 1/Km,由 y 軸交點求出 1/Vmax。 |
|
|
◆ 循一實例練習畫出動力學測定的直接作圖及其雙倒數作圖。並請注意 Vmax 及 Km 的單位是什麼,為何會得到此種單位? |
||
|
c. |
Eadie-Hofstee 作圖法: |
|
|
雙倒數圖的直線,在接近 y 軸處,打點太密,求得直線稍有困難。 若分別以 vo /[S] 及 vo 為 x, y 軸,亦可畫出直線,且各點的分佈較平均。 |
||
|
◆ The Use of the Eadie-Hofstee Plot for Determining Kinetic Parameters |
||
|
Km 的意義: |
||
|
|
Km 是酵素與基質間親和力的指標,Km 越大親和力越小。 |
|
|
■ 3.2.4.2 Km: 基質親和力 (前半段) (1/2 Vmax → Km = [S]; Km 大小) |
||
|
a. |
當反應速率為 50% Vmax 時,vo = 1/2 Vmax,代入 M-M 公式,則得: |
|
|
|
Vmax Vmax [S] ── = ────,整理得 Km = [S] (只在 vo= 1/2 Vmax 條件下) 2 Km+[S] |
|
|
|
因此 Km 的意義表示,要達到一半最高催化速率時 [S] 所需濃度。 |
|
|
b. |
若酵素的 Km 越低,則表示它要接近 Vmax 所需的基質濃度越低。若某一酵素有數種基質,各有不同的 Km,則 Km 越低的基質,表示它與酵素的親和力越大,催化反應愈容易進行。 Km 與 [S] 一樣是濃度單位 (mM 或 mM)。 |
|
|
|
■ Km hexokinase 的三種 substrates (基質立體構造的影響甚大) |
|
|
c. |
某酵素的 Km 值可看成在一般細胞內,該酵素基質的大約濃度。 |
|
|
Vmax 的意義: |
||
|
|
請確實瞭解 Vmax = k3 [Et] 的意義 (公式 IV)。 |
|
|
a. |
在足夠的基質濃度下,一定量的酵素所能催化的最高反應速率,即為其 Vmax;要讓一個酵素達致其 Vmax,就要把基質量調至最高濃度。在比較不同酵素的 Vmax 活性時,注意要以同樣莫耳數的酵素分子為基準。 |
|
|
b. |
單位時間內每莫耳酵素所能催化的基質數 (莫耳數),稱為 turn over number 或 molecular activity,一般酵素約在 0.1~10,000 間 (每秒),有大有小不等。 這是當基質量極大於 Km 時 ([S] >> Km),反應推向右邊,E + S → ES → E + P,其 k3 成為決定因素,即為 turn over number,特標記為 kcat。 |
|
|
|
■ 3.2.4.3 Turnover number k3 (後半段) (基質極大 (kcat);基質極小 2nd order) |
|
|
c. |
當基質量遠小於 Km 時 (Km >> [S] 則 [Et] = [E] 而 Km + [S] = Km),則可以由 M-M 公式導得: |
|
|
|
Vmax [S] k3 [Et][S] k3 [E][S] kcat vo = ──── = ──── = ──── = ── [E][S] Km + [S] Km + [S] Km Km |
|
|
|
反應速率成為 second order,由 [E] 及 [S] 兩項因素決定之。 |
|
|
|
而 kcat / Km 常數的大小則為重要指標,同時顯示酵素的催化效率及專一性。 |
|
|
d. |
瞭解上述的 Km 與 Vmax 後,重新回顧最早的酵素與基質反應式: |
|
|
若把此式分成兩半,前半是 E + S → ES 由 k1 與 k2 主導;後半 ES → E + P 由 k3 主導。 則顯然 Vmax 是後半反應決定 (記得 Vmax = k3 [Et]),而 Km 則大體上由前半反應所定。 因此整個酵素反應,是由這兩半反應所共同組成,前半以 Km 來決定酵素與基質的親和度,後半反應以生成物的產生來決定最高反應速率。注意 Km 的定義是 (k2 + k3) ÷ k1,故後半反應還是對 Km 有影響。 |
||
|
酵素活性定義: |
||
|
|
有兩種表示酵素活性的方式,請注意其定義不同,不要混淆。 |
|
|
a. |
活性單位: |
|
|
|
酵素活性的表示方法通常使用 活性單位 (unit)︰ 即酵素 每分鐘 若催化 1 mmole 基質 的活性,即定義為一單位活性:注意同一酵素可能會有不同定義方式的活性單位。 |
|
|
b. |
比活性: |
|
|
每單位重量蛋白質 (mg) 中所含的酵素活性 (unit),稱為 比活性 (specific activity, unit/mg);因酵素為活性分子,有時會失去活性,雖然蛋白質仍在,但比活性會下降。 |
||
|
■ 3.2.4.4 酵素活性單位 (IU) (有不同定義的活性單位) |
||
|
◆ 酵素純化與分析;酵素活性測定法 (詳細說明如何測定酵素活性) |
||
|
雙基質反應: |
|||||
|
■ 3.3 雙基質反應 (Hexokinase 也是雙基質反應) |
|||||
|
a. |
上述 S→P 催化反應,只有一種基質及一種生成物,稱為 Uni-Uni 反應。 但事實上大多數酵素反應,有一個以上的基質,也可能有數個生成物,為多基質反應。例如: |
||||
|
|
S1 + S2 |
→ | P | (Bi-Uni, 雙-單) | |
|
|
S |
→ | P1 + P2 | (Uni-Bi, 單-雙) | |
|
|
S1 + S2 |
→ | P1 + P2 | (Bi-Bi, 雙-雙) | |
|
|
|||||
|
b. |
雙基質反應仍可適用於 M-M 公式,但 兩種基質的 Km 要分別測定;測 S1 的時候,反應中的 S2 濃度要飽和 (使 S2 成為非主導因子),反之亦然。 |
||||
|
c. |
Bi-Bi 反應中基質 (S1, S2) 及生成物 (P1, P2) 的進出次序有數種情形: |
||||
|
|
(1) Random:基質進入活性區並沒有一定次序,但兩個基質都要結合到酵素後,才會開始進行反應。 |
||||
|
|
(2) Ordered sequential: 基質依固定次序進入,然後生成物再依序出來。 |
||||
|
(3) Ordered ping-pong: 依 [S1進, P1 出; S2 進, P2 出] 次序,像是兩個 Uni-Uni 組成的;也像是打乒乓球一樣地一來一往。 |
|||||
|
酵素的抑制: |
|
|
|
酵素活性的抑制,也是一個重要的調控方式。 |
|
■ 酵素的抑制:可逆 vs 不可逆 (好像汽車的煞車系統) |
|
酵素的抑制方式: |
|
|
a. |
以抑制劑與酵素結合而導致抑制作用,這種結合是 可逆 或 不可逆 反應都有。 |
|
b. |
很多生理或藥理上的作用,都是源自於抑制劑對酵素的作用,而使酵素的活性降低,或者完全失去活性。如消炎的 磺胺藥,即是一種細菌酵素基質 (PABA) 的類似物,可抑制細菌葉酸的合成。 |
|
c. |
抑制劑與酵素產生非共價性結合,然後可以阻礙基質進入酵素活性區,或者改變酵素構形而使其失活。 |
|
d. |
|
|
|
Competitive, non-competitive 及 uncompetitive (請見 圖 2 整理); 由抑制劑對酵素動力學曲線所造成的影響,即可得知是何種抑制方式。 |
|
|
|
|
圖 2 各種酵素抑制反應的機制及其動力學行為 |
|
|
不可逆的抑制: |
||||||||||||||||||||||||||
|
不可逆性抑制劑會對酵素活性區上的主要胺基酸做 共價性修飾,因此酵素活性通常被嚴重破壞,便無上述三種動力學抑制方式。 |
||||||||||||||||||||||||||
|
a. |
青黴素 (penicillin) 喬裝成基質,可與細菌的一種酵素發生不可逆的結合,此酵素乃細菌細胞壁生合成的重要酵素,細菌無法正常生成細胞壁而死亡。 有點像是分子版的『木馬屠城記』。 |
|||||||||||||||||||||||||
|
|
■ 不可逆的抑制 (抗生素 penicillin 例子) |
|||||||||||||||||||||||||
|
b. |
重金屬:Hg2+, Pb2+, Cd2+ 及砷化物等重金屬,非專一性地與 [E] 或 [ES] 結合,取代原來酵素所需的金屬,而使酵素失去活性。 |
|||||||||||||||||||||||||
|
c. |
化學修飾劑: 某些化合物可以 專一性 地修飾特定胺基酸,除了可做為專一性抑制劑外,也可用來檢定酵素活性區中,具有催化反應的胺基酸為何者 (表 1)。 |
|||||||||||||||||||||||||
|
表 1 若干蛋白脢的抑制劑及其作用機制: |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
◆ 日本真理教所用的沙林毒氣 (Sarin) 是一類似 DIFP 的抑制劑。 |
||||||||||||||||||||||||||
|
d. |
蛋白脢及其抑制劑: 蛋白脢廣泛存在於細胞中,有其專一性抑制劑可控制其生理活性,二者互相抗拮形成一調節控制網。 目前極被重視的 HIV 蛋白脢及其人工抑制劑,在醫藥研究上有很大的作用及影響。 |
|||||||||||||||||||||||||
|
◆ 有關蛋白脢的分類,請見 6.1.2 一節。 |
||||||||||||||||||||||||||
|
◆ A Protease and Protease Inhibitor Web Server (法國 Tours 大學的蛋白脢網站) |
||||||||||||||||||||||||||
|
■ 酵素抑制劑在醫藥上的功用 (一些重要實例) |
||||||||||||||||||||||||||
|
■ HIV Protease vs Acid Protease 比較 (利用構形對稱性的差別) |
||||||||||||||||||||||||||
|
◆ HIV Protease (HIV protease 立體模型,需要 Chime) |
||||||||||||||||||||||||||
|
◆ An Accurate Look into HIV (如何有效抑制 HIV protease) |
||||||||||||||||||||||||||
|
◆ HIV Protease (OMM 分子模型館,需要 Chime) |
||||||||||||||||||||||||||
|
|
建立日期:2001/3/8 更新日期:2005/09/18 © 版權所有