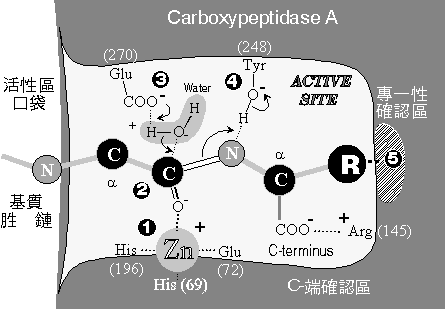
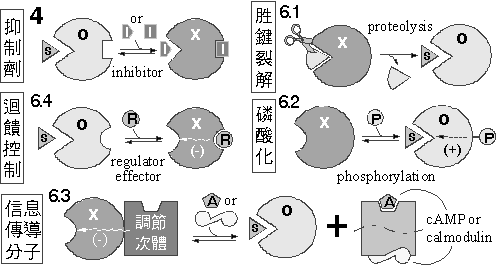
|
|
▲
|
|
5.3 |
順序式催化機制︰ |
| |
以
chymotrypsin (CT, 胰凝乳蛋白脢)
為代表,請找出課本的相關圖片。 |
|
a.
|
分子構造:
CT 的分子量為 25 kD,含三條胜肽,由兩個雙硫鍵連接,是
轉譯後修飾 的產物;剛轉譯出來的完整胜肽鏈沒有活性,要在接近
N-端的 Arg 15 與 Ile 16 之間先斷開後,CT 才能活化。 |
|
b.
|
催化活性:
CT 可水解胜肽鏈上面的芳香族胺基酸 (Tyr,
Phe, Trp) 或 Met (具較大非極性基團者),切開這些胺基酸
C-側的胜鍵,是一種
內切脢。 |
|
c.
|
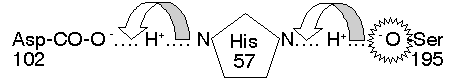
活性區:
CT
大部分的極性胺基酸都露在分子外表,只有三個在活性區內,對催化反應扮重要角色
(Ser 195, His 57, Asp 102)。三者以『電荷接力』形成
高反應性 Ser:其 Ser 195-OH
基上的 H+ 被鄰近的 His 57
吸收,生成具有高反應性的 -O-。 |
|
F4 |
|
|
|
 |
|
|
圖
4 Ser 蛋白脢催化區上由三個胺基酸所構成的電荷接力
(動畫) |
|
|
|
|
|
■ Cymotrypsin 活性區
(催化鐵三角)
|
|
|
■ pI 與環境 pH 的關係
(pH 會影響分子的帶電性質)
|
|
|
◆
Bonding and Protein
Structure (以 chymotrypsin 說明分子的鍵結力量,需 Chime)
|
|
|
|
|
d.
|
催化機制:
Ser 上的高反應性 -O - 會攻擊基質胜肽上的
carbonyl
碳 (帶微正電),形成新的 C-O 鍵 (acylation 步驟),同時斷開基質的胜鍵,先釋出一段
C-側的胜肽;然後加水分解,破壞此 C-O 鍵 (deacylation 步驟),釋出另一段
N-側胜肽。以上兩個步驟,依次順序發生。 |
|
|
■
Chymotrypsin 的催化機制
(以動畫圖解上述的催化機制)
|
|
e.
|
穩定過渡狀態:
除了 catalytic triad
可以有效催化之外,活性區也可以穩定催化反應的中間過渡狀態;過渡狀態有相當高的負電荷,因此以活性區附近的
Gly 193 及 Ser 195 本身的 -N-H 與之產生氫鍵而中和之。 |
|
f.
|
Ser
蛋白脢家族: 這種以 Ser
為催化主力的蛋白脢很多,統稱為 Serine
型蛋白脢;除了 chymotrypsin 外,尚有許多如 trypsin
(胰蛋白脢)、elastase (彈性蛋白脢)。它們的催化機制相似,立體構形相當類似,且都有
[Ser-His-Asp] 接力形式的催化機構。
但對基質的專一性不同,trypsin 的基質為鹼性胺基酸 (Lys,
Arg),elastase 則只切 R 基團較小且不帶電荷者。 |
|
|
◆
Chymotrypsin
(Stryer
Biochemistry 試用網路版 Fig 9.6,僅供 Netscape + Chime)
|
|
|
|
|
6.1.1 |
脢原或前驅體: |
| |
以蛋白質的裂解來調節酵素活性,該酵素在裂解後得以活化;也可以把完成任務後的蛋白質分解掉,以免繼續進行著生理作用。 |
|
a.
|
許多酵素
(或蛋白質) 剛由 mRNA
轉譯成蛋白質時,分子量較大而不具活性,稱為 脢原
(zymogen);在蛋白質則稱 前驅體
(precursor)。
脢原或前驅體再經蛋白脢切開,或除去部分胜肽,才能成為具有活性的分子。
請研究下面數例,注意 胰島素及腦啡是荷爾蒙而非酵素,而打有
* 號者乃表示具有活性者。 |
|
cascade
|
(1)
凝血脢: Prothrombin → Thrombin*
→ (凝血反應) |
|
|
凝血機制
凝血對生物體是一件很嚴重的事,因為血液不能在血管內任意凝固。因此細胞對誘發凝血的過程,控制得非常嚴格,是以一種叫做『梯瀑
cascade』的方式,把一個信息慢慢放大;而在放大過程中,有許多管制點,可避免因假警報誤導致凝血。上面的凝血脢生成是最後一步,凝血脢可以馬上誘發凝血。 |
|
|
(2)
胰島素: Preproinsulin → Proinsulin
→ Insulin* |
|
|
轉譯後的
preproinsulin 先摺疊好以後,切除
N-端的一段胜肽成為 proinsulin,然後再切除中央一段
C
胜肽後,才會有活性。 |
|
|
(3)
腦啡: |
|
|
先合成一長條八元體的前驅體,再以一種類似
trypsin
的蛋白脢裂解成單位腦啡,因此其產生也受到蛋白脢的控制。 |
|
b.
|
許多破壞性酵素
(如蛋白脢)
先以脢原形式合成出來,以免在到達作用目標前破壞其它蛋白質;也有以胞器或細胞膜隔離者,稱
區隔化
(compartmentation)。 |
|
|
Chymotrypsinogen
→ π-Chymotrypsin* → α-Chymotrypsin* |
|
|
Chymotrypsinogen
分子的斷裂會使其構形改變,露出新的 N-端 Ile 16,這個新的
-NH3+ 會吸引 Asp 194 的酸基,進而固定隔壁的
Ser 195,使其就定位,並因此打開專一性結合區,轉變成為活性型。 |
|
|
■ Protein degradation 例子
(不可逆的共價性修飾) |
|
c.
|
這種脢原裂解的活化方式是不可逆的,因為被切掉的片段無法接回;因此細胞以
抑制劑
(inhibitor) 來控制此類酵素。Trypsin
及其抑制劑為一範例,trypsin
被切開活化之後,只能用其專一性抑制劑去控制。 |
|
|
■ Protein degradation
(很複雜的調控機制) |
|
|
|
|
6.1.2 |
蛋白脢: |
| |
越來越多的研究發現,蛋白脢在細胞內具有重要的生理功能。 |
|
a.
|
依催化機制可分成四類:
(1) 金屬蛋白脢 (2) Serine 蛋白脢 (3)
Cysteine (或 Thio)
蛋白脢 (4) Aspartyl (或 Acid)
蛋白脢。 |
|
|
■
蛋白脢種類 (以活性中心分類)
(Metal, Ser, Cys, Asp 四大類) |
|
b.
|
同一族的蛋白脢序列都具有類似的胺基酸序列及構形,尤其在活性區的保守性胺基酸幾乎絕對不會改變
(如 Ser 蛋白脢的 catalytic triad);其它序列則因 趨異演化
而衍生出許多具有不同專一性的蛋白脢。
與蛋白脢構造完全無關的 acetylcholinesterase,則因 趨同演化
而具有類似 catalytic triad 的 ester 水解能力。 |
|
|
■ Genetically engineered subtilsins
(Triad 各胺基酸的重要性) |
|
|
■ Molecular evolution 分子演化
(AchE vs Ser protease) |
|
c.
|
類似核酸的
intron 與 exon,蛋白質也有自我剪接的現象,稱 intein
與 extein,是轉譯後的修飾作用;但此現象並不是很普遍。 |
|
|
■ Intein & extein
(Intein 被切除後再把 extein 相連接) |
|
|
|
|
6.3.3 |
信息傳導路徑: |
| |
當荷爾蒙或細胞激素等胞外信息分子到達目標細胞,與胞膜上的專一性受體結合後,就會引發該細胞的一連串反應,把胞外信息帶入細胞內,以啟動所要的生理反應。細胞內的這些反應,相當複雜而有效,統稱為
信息傳導;由上面所述的磷酸化及
cAMP
等小分子為主軸,加上目標酵素的活化,可分成幾個層次,各層次由許多模組所構成。 |
|
|
下面整理出這幾個層次,並且舉出一個對應例。 |
|
|
Signal
→
Receptor →
Transducer →
Effector enzyme →
Effector →
Effect |
|
|
對應的分子如下例: |
|
|
Glucagon
→
Receptor
→
G-protein → Adenylate cyclase →
cAMP →
Kinase
|
|
|
■
信息傳導的上中下游整理
(1) 放大效果 (2) 彈性組合; 梯瀑 |
|
|
◆
Signal
Pathways: Response and Recovery (Stryer
生化課本 的動畫教材) |
|
|
◆
Signal Transduction
Knowledge Environment (Science
的信息傳導網路專欄) |
|
|
這種傳導途徑有兩個特點,是細胞生理極為重要的手段: |
|
a.
|
放大作用
(amplification): |
|
|
上述一層一層的傳導過程中,有些是酵素
(如 cyclase, kinase);而一個酵素分子若經活化,代表著將有大量的基質會被催化成生成物,而生成物會再傳導給下一步反應,信息因此而被放大。這種方式,非常像真空管的電流放大作用,也是上述
cascade 梯瀑式放大的一種。 |
|
b.
|
彈性模組
(flexibility): |
|
|
信息傳導的每一步代表一個層次,而每個層次可由各種模組所組成,因此可以有不同彈性組合,以因應不同細胞的種種需要。 |
|
|
|
|
6.4.1 |
Aspartate
transcarbamoylase (ATCase): |
| |
ATCase
是典型的異位脢。 |
|
|
■
異位脢 ATCase (催化次體 C 的構形變動) |
|
a.
|
迴饋控制:
ATCase 催化 aspartate 與 carbamoyl-P 連結成 carbamoyl aspartate
的反應,後者經代謝後生成 CTP; CTP 則回頭與 ATCase
上的 調節區
結合,反而抑制 ATCase 的活性 (負迴饋)。
由於 ATCase 是這個反應鏈的起始酵素,控制 ATCase
即可控制整條代謝路徑。 |
|
b.
|
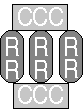
四級構造:
ATCase 是由兩組 催化次體
(catalytic subunit, CCC) 以及三組 調節次體
(regulatory subunits, RR)
組成;每組催化次體由三條蛋白質組成 (C, 34 kD),每組調節次體由兩條蛋白質組成
(R, 17 kD): |
 |
|
|
2
× (CCC)
+ 3 × (RR) = C6R6 |
|
|
每調節次體有一
效應物結合區,每催化次體有一 基質結合區。 |
|
|
■
異位脢的迴饋控制 (ATCase 異位調控的性質整理) |
|
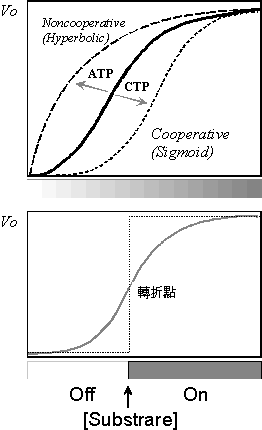
c.
|
S
型曲線: ATCase 的動力學結果顯示,以 vo
對基質 [Asp] 濃度直接作圖,可得到一 S
型曲線 (sigmoidal curve),而非典型的 M-M 單股雙曲線
(見 圖 9)。 這是 合作式
(cooperative) 的 協力現象,表示基質與酵素之任何一個次體結合後,可誘導改變酵素的分子構形,促進其它次體與基質間的結合能力
(positive homotropic effect)。 |
|
|
■
基質控制酵素活性 (分子開關)
(察覺環境的基質濃度 → On/Off) |
|
d.
|
分子開關:
此 S
曲線有一轉折點,基質在達到這個基質濃度後,酵素反應速率急速上升。
可以將此轉折點看做酵素對其環境基質濃度的
感應點,當基質濃度低於轉折點時酵素不太活動;而達到轉折點時,酵素便很快起動達到
Vmax (圖 9
下圖誇張為虛線,以突顯此轉折點)。 |
|
e.
|
協力現象:
若反應加入 CTP,則 圖 9 上圖的 S
型曲線下移 (但 Vmax 不變),表示 CTP 會降低
ATCase 的活性 (negative heterotropic); 而 ATP 則反可增強
ATCase 活性 (positive heterotropic),但原 S
型曲線則變成一般的 M-M 雙曲線,協力現象消失。 |