| |
|
E504 |
|
|
 |
|
|
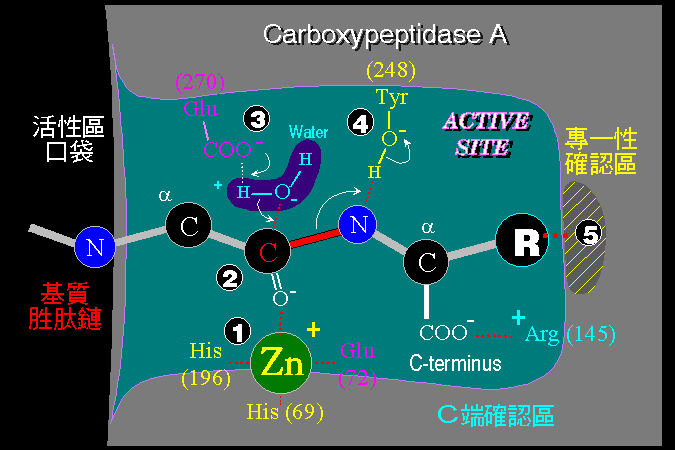
Cymotrypsin 活性區
|
|
|
|
|
|
Chymotrypsin
屬於 Ser protease,是一類極為特殊的酵素,也是演化上極為成功的催化例子;其特點在於利用很平常的一般胺基酸基團,即可以組合出相當強的反應基團,這全靠它的催化鐵三角
(catalytic triad)。
|
|
|
|
|
|
Catalytic
triad 因為相鄰三個胺基酸基團的互相吸引,使 Ser 195
上的 -OH 質子被 His 57 搶走,而成為具有超強反應性的 -O
-。此 -O - 攻擊目標蛋白質胜肽鍵上的碳 (carbonyl C+),開始了順序式的胜肽鍵水解催化機制。
|
|
|
|
|
|
在課堂上我們將循著上面這張整理大綱,一一說明
chymotrypsin 的性質:
|
|
|
(1)
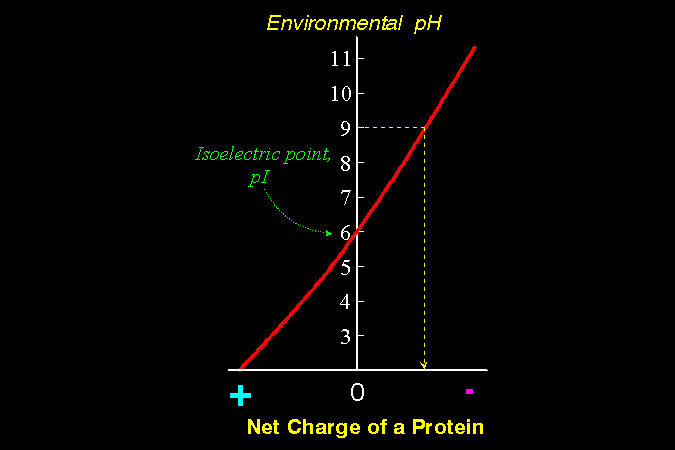
如何佈置催化鐵三角,以及環境 pH
及修飾劑對活性區的影響
|
|
|
(2)
詳細的催化機制,可分成兩大步驟,依序進行切開胜肽鍵的反應
|
|
|
(3)
如何穩定中間過渡產物,還是與活性區附近的胺基酸有關
|
|
|
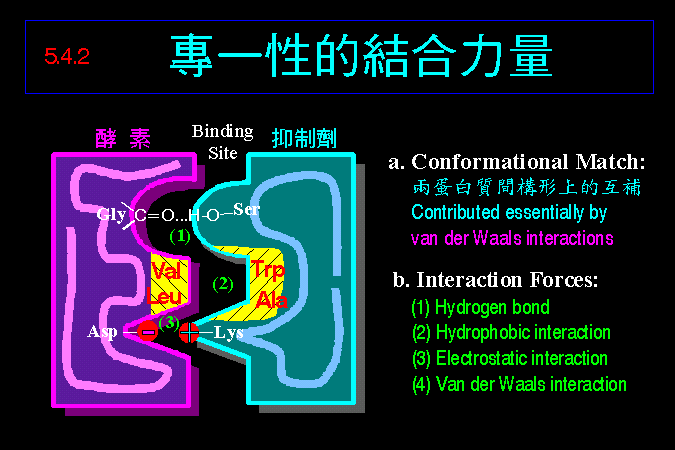
(4)
如何辨別其基質上的胺基酸基團,以便專一性地水解之
|
|
|
|
|
|
有關
chymotrypsin
酵素催化機制方面的研究,在早期的生物化學上,是一段精彩而極有趣的故事,可以給我們在酵素化學的研究工作很多啟示;有一本由
Scientific American Library 出版的通俗科學書籍 Discovering
enzymes (by D. Dressler & H. Potter, 1991),給了極詳細且有趣的解說。
|
|
|
|
|
|
■
Chymotrypsin 的催化機制
(以動畫圖解上述的催化機制)
|
| |
■
到講義相關部份 |
■
到幻燈片集成 |