|
|
||
|
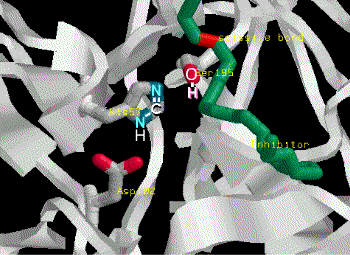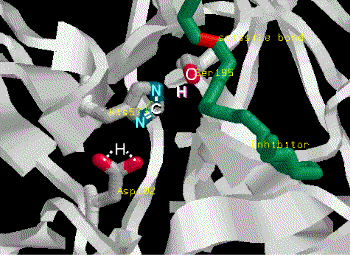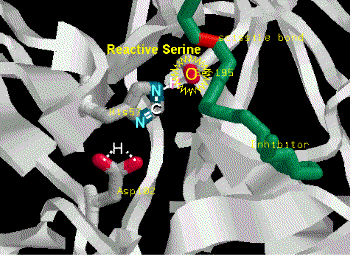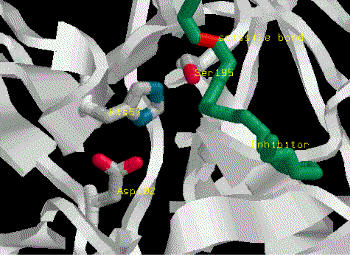
Catalytic mechanism of Carboxypeptidase A |
||
|
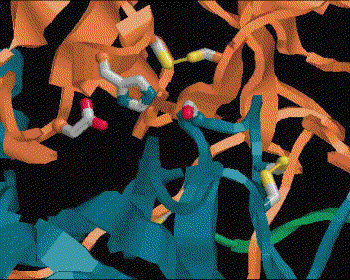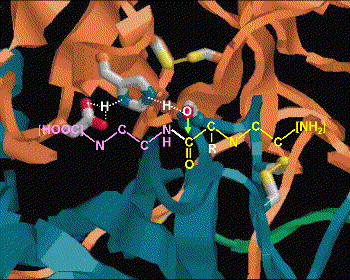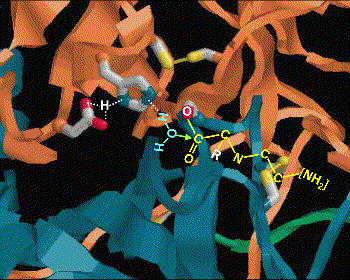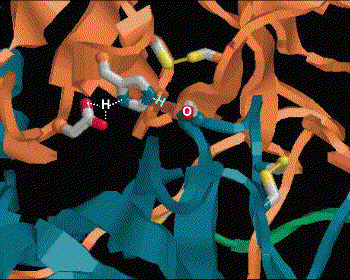
(1) Zn2+ 離子乃重要輔助因子,可吸住基質胜肽鍵上的 carbonyl 基,增強其極性,使 (2) 碳帶正電。 |
||
|
(3) Glu 270 吸住水分子,放出 OH- 攻擊 C+ (2),產生新的 C-OH 鍵。 |
||
|
(4) Tyr 248-OH 上的質子,與氮 lone pair 電子產生新鍵,原來的胜鍵斷裂。 |
||
|
(5) 附近的胺基酸與基質 C-端的 R 基團,有專一性的結合,以辨別基質的極性;同時 Arg 145與基質 C-端的 COOH 結合,確定基質蛋白質是以 C-端進入活性區。 |
||