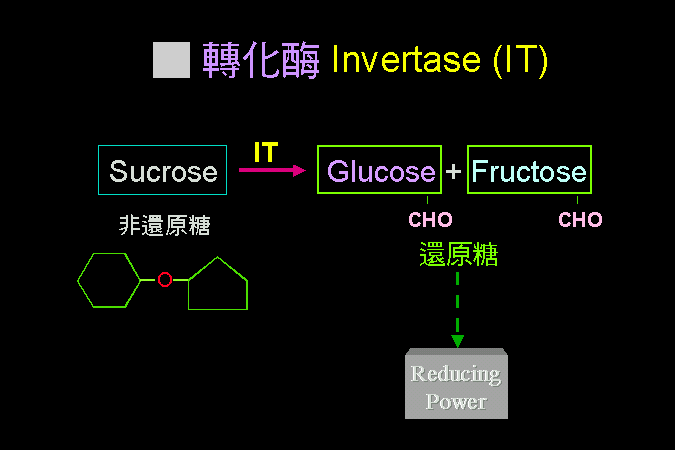
目錄 第 3 節 酵素動力學
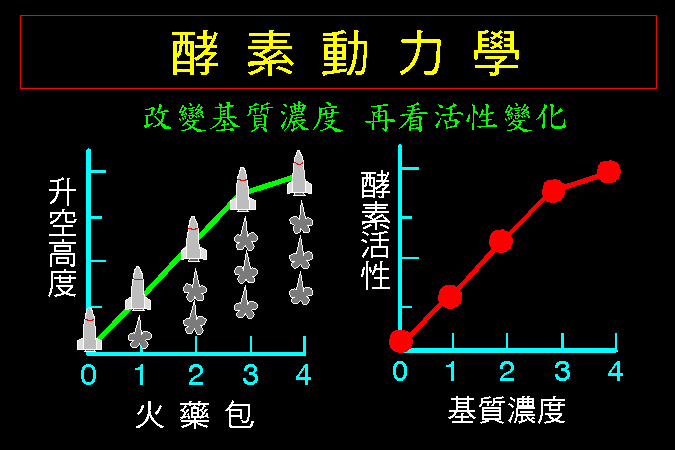
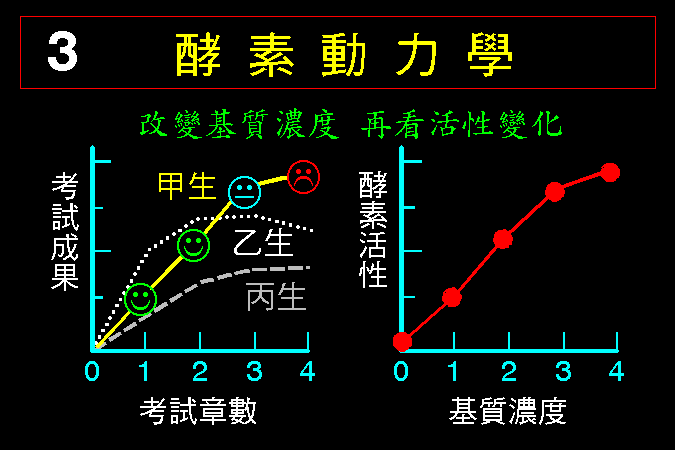
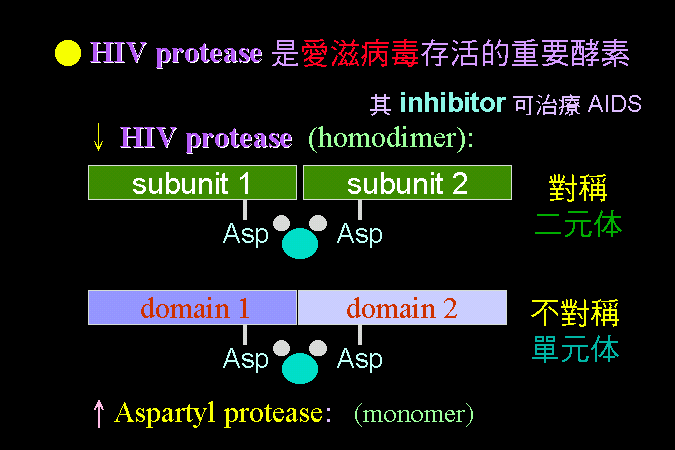
酵素 的主要作用是催化基質的轉換,因此若我們改變基質的濃度,再來觀察酵素活性的變化情形,則可得知酵素與基質間的一些關係,此即酵素動力學 (第三節)。 此種觀察也可以加入抑制劑,看抑制劑如何影響酵素與基質間的作用關係 (第四節)。接著,我們解釋酵素對基質的催化機制是如何進行的,可以完全以有機化學的反應機制來說明之 (第五節)。
若把酵素看成一部汽車,我們先以命名法稱呼汽車的名字 (酵素的命名),再大體看這部車子的組成 (酵素的構成),然後知道其馬力等動力學性質 (酵素動力學),並且要檢查煞車情形 (酵素的抑制),更仔細檢查其引擎的運作機制 (酵素的催化機制),以及駕駛或控制此汽車的方法 (酵素活性調節)。一切都完備之後,汽車就要上路,在代謝的大馬路上馳騁 (細胞代謝與酵素調控),並且發現此汽車可以帶我們完成很多應用 (最後一節)。
第三節 酵素動力學
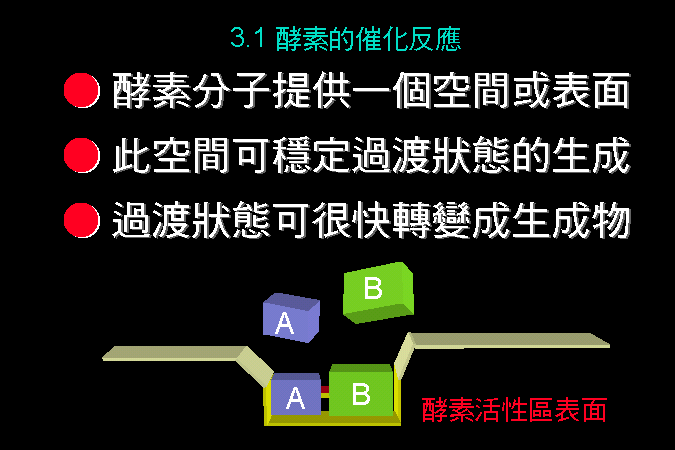
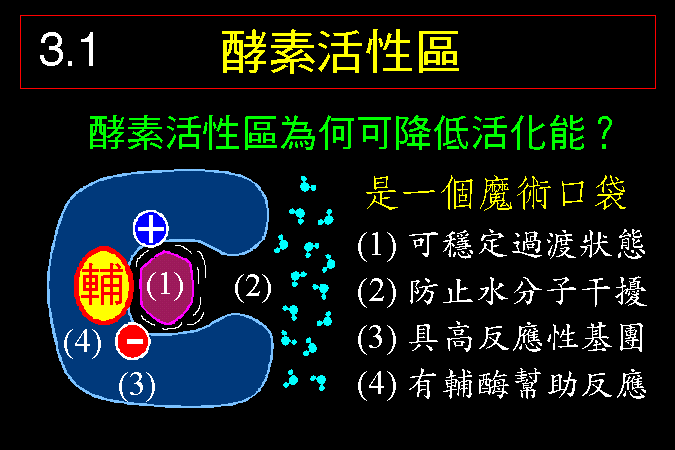
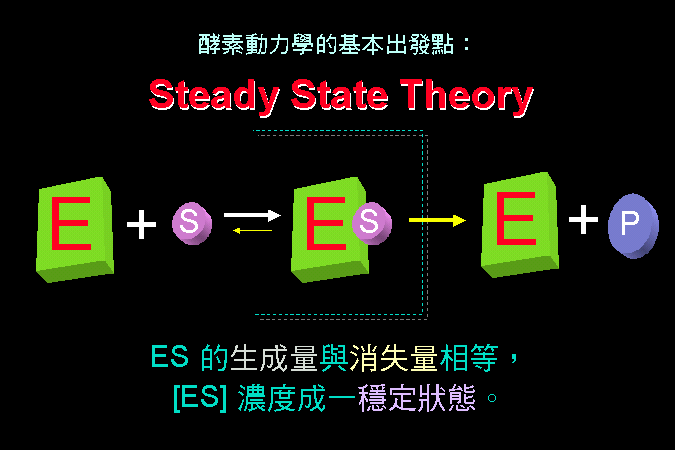
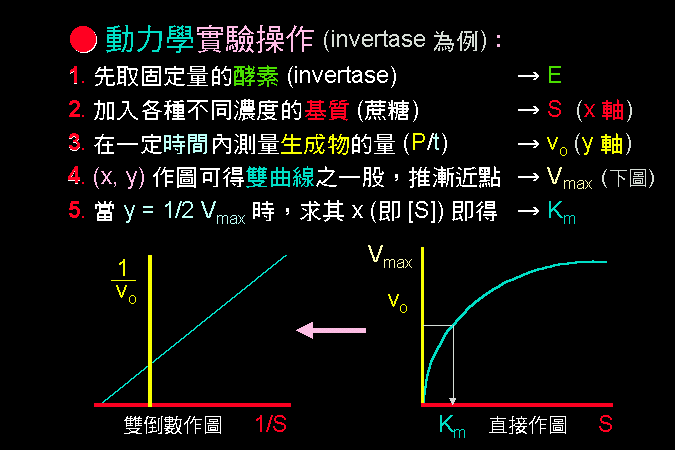
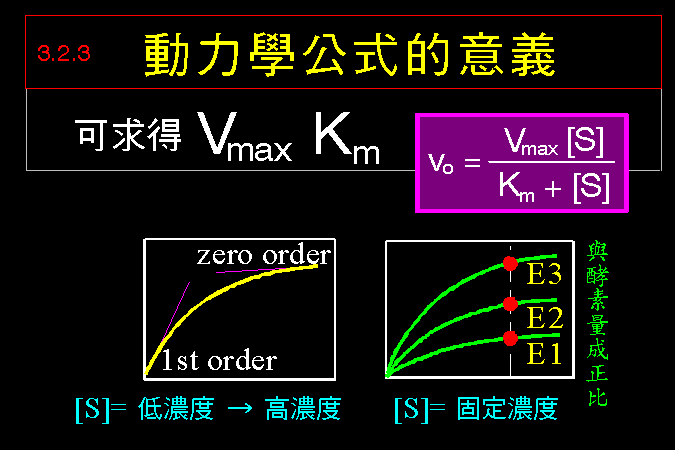
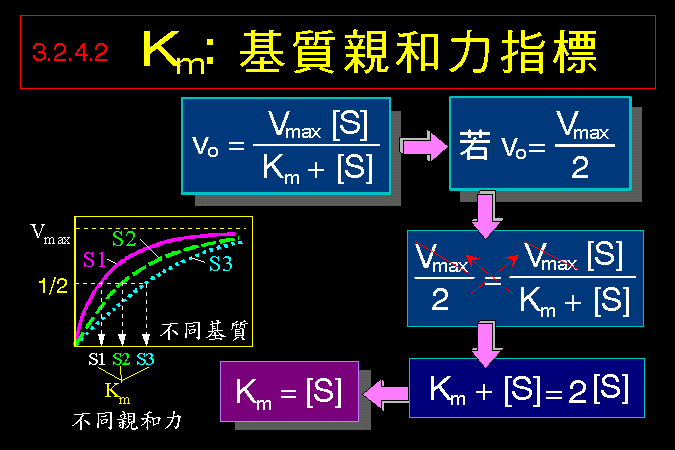
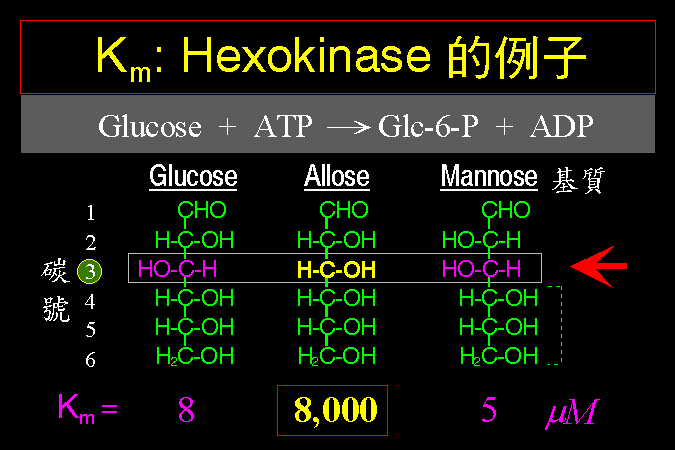
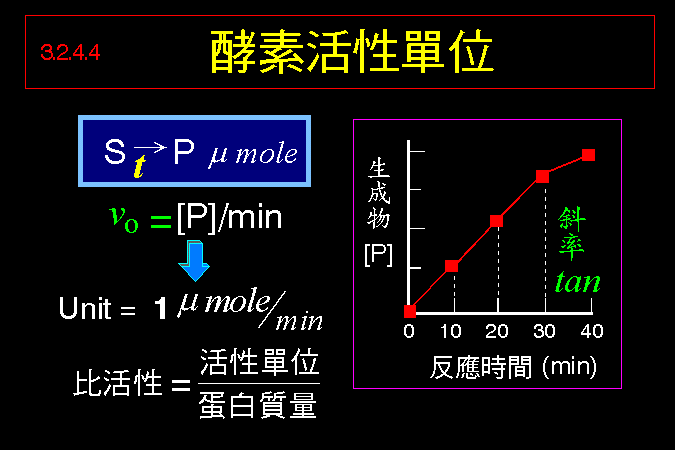
3.1 小節先介紹酵素催化反應的一些基本觀念,最重要的是酵素 [E] 如何與其基質 [S] 結合,結合之後 [ES] 如何被催化而反應,這將是以下所有的酵素性質與行為的基礎與根本。 3.2 小節緊接著圍繞著 [ES] 推導出酵素動力學,以 Michaelis-Menten 公式說明酵素的催化特性與行為,並求得該酵素最重要的兩個性質參數:Vmax 及 Km。 接著 3.3 小節簡要說明多基質、多生成物的催化形式,發現與單基質、單生成物反應的機制差不多。
■ 到講義相關部份