| �@ |
�@ |
E611 |
|
|
|
|
�@
|
6.2 �x���C���Q GP (�@������)
|
|
�@
|
�@
|
|
�@
|
�x�}�C���Q
(GP)
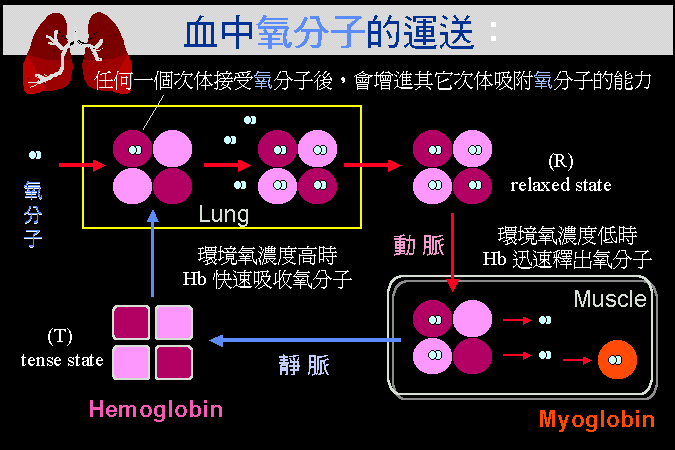
�i�H��x�}�i���C�Ѥ����A�Ѩx�}���쪺���I�}�l�A�⸲��}�@�ӭӤ��U�ӡA�åB�[�W�C�Ħ���
Glc-1-P�A��̥i�H�i�J�}�ѧ@�ΥH���ͯ�q�C
|
|
�@
|
�@
|
|
�@
|
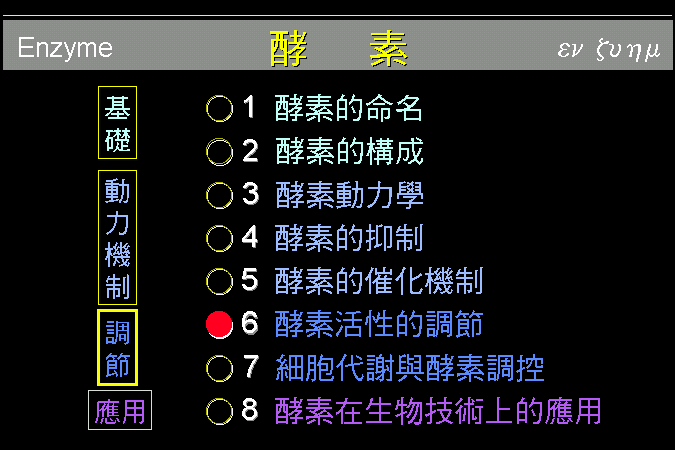
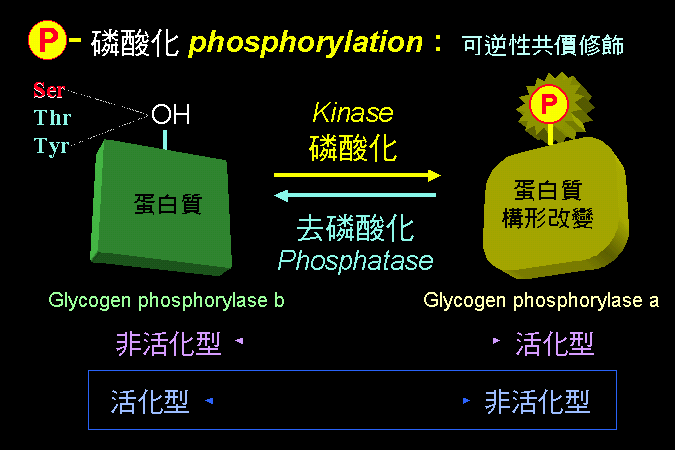
���`
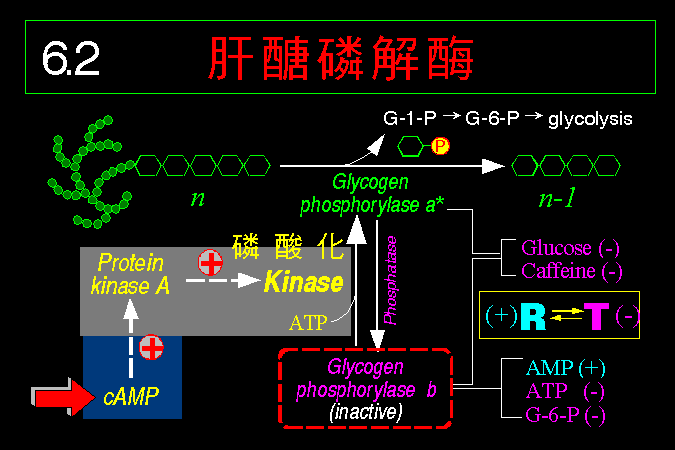
GP �O�H�������D�� b ���s�b�ۡA�n�Ψ�M�Ϊ��E�Q (GP
kinase) �i���C�ĤơA�~�����㦳���ʪ� a
���C�Ӧ��E�Q�n����t�@�ؿE�Q (protein kinase A, PKA)
���C�ĤƤ~�|�����ʡA�~��h�C�Ĥ� GP�F�� PKA
�S�n���� cAMP �����ƫ�A�~�����ʡC
|
|
�@
|
�@
|
|
�@
|
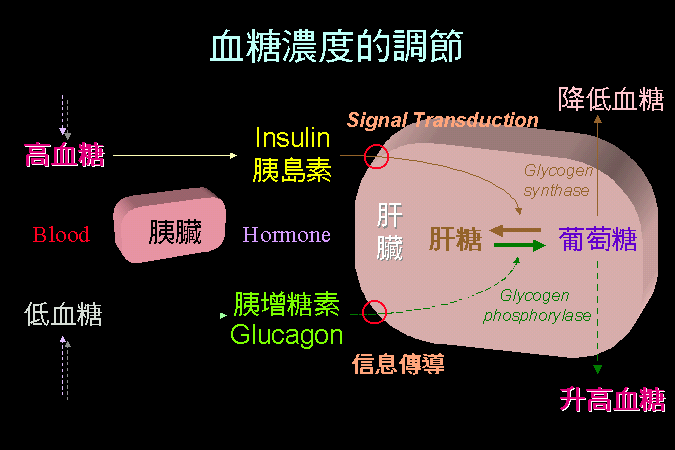
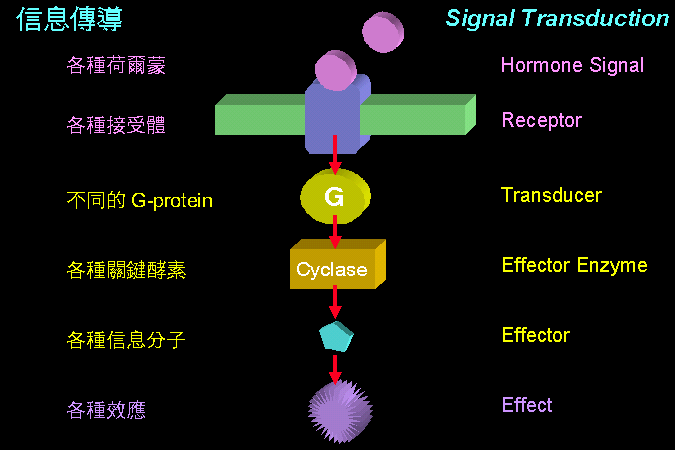
cAMP
�O�@�ӭ��n���H���Ǿɤ��l�A�������X glucagon
�P�ؼвӭM���X��A�N�b�M����������W���o�M��������
G protein�A��̷|���� ATP cyclase �ϱo ATP ���� cAMP�C�]���o�@�����|�N��~�ɲ����X�ҶǨӪ��H���A�g��
cAMP �Ǩ� PKA�A�A�Ǩ� GP kinase ��A�Y�i���� GP
�}�l����ӭM���ȡA��x�}���Ѧ���}�A�H�ѲӭM�ΤH��һݡC
|
|
�@
|
�@
|
|
�@
|
�W�z�C�Ĥƥu�O
GP
���@�ؽո`�覡�Ӥw�A�O�ݩ�@���䦡���i�f���A�]���C�Ĥƫ᪺
GP �]�i�H���C���Q (phosphatase)
�h���C�ġA�H��_��D���ʫ� b�C�t�~�AGP
���ʤ]�����N�ª����v�T�A�Ҧp����}�����Ӧh����}�ί�q���l�A��ܤ��ݭn�A���Ѩx�}�F�F����}�ί�q���l
(�p Glc-6-P, ATP) �i�H�����P GP
���X�A�H���t���C�䬡�ʡC
|
|
�@
|
�@
|
|
�@
|
�]���AGP
���F�C�ĤƤ��~�A�䬡���٥i�H���� AMP, Glc-6-P
���p���l�ҽո`�F�o�Ǥp���l���O���X�b�䬡�ʰϥH�~���a��A�O�����ʰϪ���m�A�]���S�٤��������Q
�C
|
|
�@
|
�@
|
| �@ |
��
�����q�������� |
��
��ۿO������ |