|
5 蛋白質構造與組成分析︰ |
||
|
以下的檢定方法,需要純度極高的蛋白質,因此最好在一般的層析法純化後,再以製備式電泳得到均質蛋白質。 其中很多反應會與胺基反應,因此樣本中不能含有具胺基的物質 (如 Tris 或其它胺基酸),以免干擾反應。 |
||
|
5.1 N-端或 C-端胺基酸決定: |
TOP ▲ |
|
|
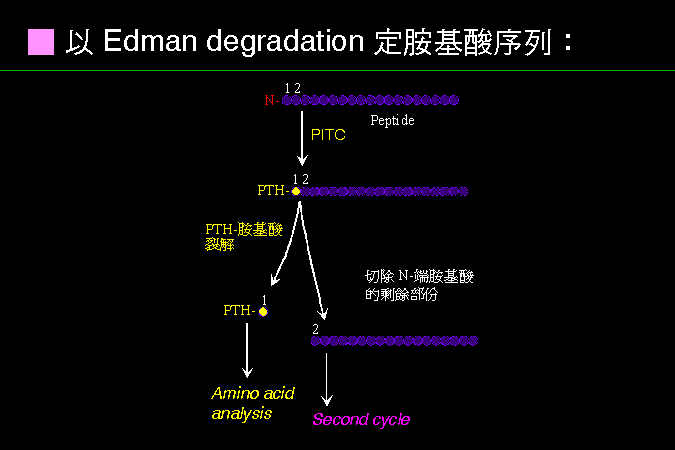
現在已經很少只是測定 N-端,通常都直接去定序。 |
||
|
|
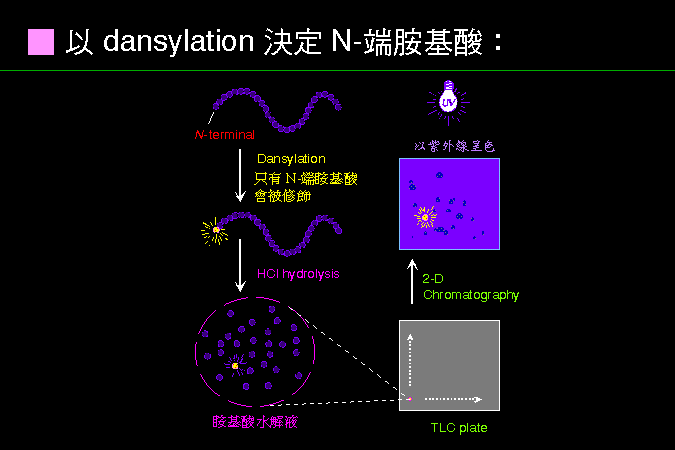
a. 一般蛋白質都有固定的 N-端及 C-端,N-端胺基酸可使用 dansylation 標以 dansyl 基團,再以 HCl 水解蛋白質。 除了 dansylation 之外,尚有許多類似的反應可用來檢定 N-端胺基酸 (圖 5.1)。 |
|
|
|
||
|
圖 5.1 以 dansylation 檢定 N-端 |
||
|
b. 水解所得的游離胺基酸以 polyamide (TLC plate) 進行 雙向薄層層析 分離,標有 dansyl 的胺基酸在 UV 光下會發出螢光,與已知的 20 種 dansyl 胺基酸比較,即可推判;亦可用 HPLC 分離胺基酸。 |
|
|
|
c. 有些蛋白質的 N-端胺基可能經 乙醯化 或其它修飾而阻礙 (blocked),無法進行反應,尤以植物來源的蛋白質為甚;遇此情形,可能要分出胜汰片段來定序,或者以化學反應去除此一修飾。 |
||
|
d. 有些蛋白質含有數條胜汰鏈,由 雙硫鍵 連接起來 (如 chymotrypsin),因此會有數個 N-端胺基酸。 則要先打斷雙硫鍵,把游離的各段胜汰分開後,再行定序。 |
||
|
e. C-端可用 外切脢 carboxylpeptidase 一個一個切下來,再進行胺基酸測定,由胺基酸出現的多寡順序,即可得知 C-端序列;但因水解反應不好控制,較不常用。 |
||
|
TOP ▲ |
||