|
酵素純化 Enzyme Purification 1 蛋白質抽取 Protein Extraction |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
1.1 如何開始? 5W: What, Why, Where, When, How 1.2 材料來源 1.3 均質與抽取 1.4 鹽析及沈澱法 |
抽取蛋白質一定會用到的離心機 |
下載 [內文 pdf] [投影片 pdf] [影音檔 mp4] {BCbasic}
|
|
1 蛋白質抽取 |
參考資源 |
|
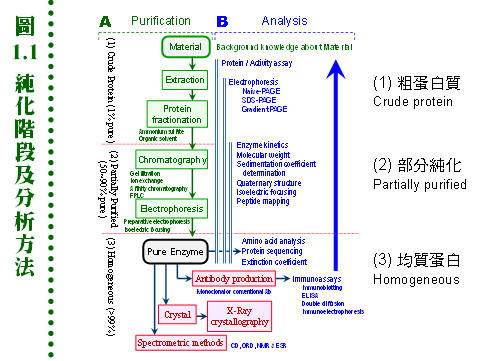
蛋白質的純化過程,可略分為三個階段: (1) 粗蛋白質 (crude protein)︰由採樣開始 → 均質打破細胞 → 抽出全蛋白質,多使用鹽析沉澱法,可去除蛋白質以外的物質,並粗略地沈澱出目標蛋白質,都是利用蛋白質的基本物理化學性質,沒有什麼高科技但極為關鍵,令人深入 体驗蛋白質的基本性質。 (2) 部分純化 (partially purified)︰最主要的純化階段,大多使用各種管柱層析法,乃是蛋白質純化的當家舞台,使用工具最多樣且有趣,通常都有大幅度的純化效果。 (3) 均質蛋白 (homogeneous)︰目標蛋白質更精製純化至均質,可用製備式電泳或 HPLC,通常到此階段的回收率都很低,除非有特殊需求,否則不需達到如此高純度。 每個階段使用不同純化策略,並伴隨各種分析方法去評估蛋白質的質量,以監測純化效果與回收率,最後所得到的純質蛋白質,可進行更精密的分析與應用。全貌匯整於圖 1.1。 (每張圖表均連結有 960 x 720 清晰版本) |
{蛋白質純化技術} |
1.1 如何開始:先考慮以下諸點: 5W a. 要純化那一個蛋白質? What? (全面收集好目標蛋白質的所有相關資訊) b. 為何要純化此蛋白質? Why? (仔細想一想整個研究的預定目標與期望) c. 由何種材料純化? Where? (要選對材料並釐清分布在細胞內的位置) d. 在那一個生長期? When? (找錯生長期就很難取得足量目標蛋白質) e. 如何純化目標蛋白質? How? (依據目標蛋白質的性質來設計純化流程)
|
|
1.2 材料來源:抽取蛋白質或酵素的材料來源,通常不外動物、植物及微生物,或用動植物的細胞或組織培養。採樣時,應考慮在那一個生長期、那一個器官或組織中,含有最高的含量。材料的採集影響實驗的成敗,遇到材料採集有困難,或者材料品質不穩定時,更是花費時間、精神。一定要控制穩定的材料來源! 植物細胞與動物細胞在構造上有許多差異,因此在材料的選擇上,應特別注意。植物的細胞壁相當堅硬,要用相當大的力量才能打破。其細胞內的區隔較動物細胞複雜,有很大的液泡,內藏低 pH 溶液以及蛋白酶等『有害』物質。另含有葉綠体及澱粉粒,亦是植物細胞的特徵。不同來源的材料,各有特定的採集或抽取問題,要自行嘗試解決。 材料採集後馬上進行抽取,是為上上策。但在很多情況下,材料必須冰凍貯存一段時期後,才進行抽取,則應在採集後,儘速置於 -20℃,通常先以液態氮冰凍後貯於 -70℃ 冷凍櫃。冷凍冰箱的除霜循環,可能對細胞造成傷害,要特別小心。解凍越快越好,但避免局部過熱。有些蛋白質或酵素材料可乾燥起來保存,在無水狀況下,可免受蛋白酶或水分子晶体的破壞,一般可用冷凍乾燥法,或製成丙酮粉末。 |
|
|
|
|
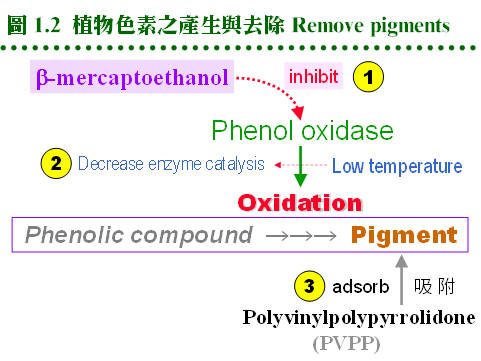
1.3 均質及抽取:目標蛋白質若在細胞之內,則抽取的第一步,就是先打破細胞,有難有易。例如動物的紅血球,只要改變滲透壓即可脹破,但植物的癒創組織就很堅固,要用海砂用力研磨。有些實驗要收集細胞內的 胞器 (organelle),則需以溫和的方法打開細胞後,再用密度離心法分離各胞器;此步驟難度較高,要參考文獻多試幾種方法。 就一般材料而言,可能用到的方法列舉如下: (1) 乾式: 不用加緩衝研磨液,直接研磨成乾粉。 液態氮研磨:材料在液態氮中凍結,以研砵打碎材料後研磨成粉。 磨粉機:類似果汁機,原本用在乾磨中藥藥材成為藥粉。 球磨機 (ball mill):以小球增加碰撞及研磨面積,多用在研磨酵母菌。 (2) 溼式:都要在低溫下研磨。 均質器:玻璃或鐵氟龍材質,是較溫和的研磨方法。 果汁機 (Waring blender):每打一分鐘,要間歇數分鐘降溫,重複進行數次。 Polytron:高速電動研磨機,效率極高,目前最常用的均質器。 研砵:磨成細粉後的材料,再加入海砂或玻璃砂助磨;傳統而實用。 玻璃球 (glass bead)︰以很細的玻璃球混在樣本中,用力振盪,可打破酵母菌。 超音波震盪 (ultrasonication):以超音波打破細胞,多用在微生物材料。 French press:將樣本加壓快速通過細孔,以剪力破壞細胞。 分泌性的蛋白質,多散佈在材料中,只要研磨均勻,大多可抽取得到。但在均質前,通常都要把材料先切成碎片 (增大表面積),才容易進行抽取。很多情況下,要先以磨粉機或果汁機打碎,否則抽出率不會很高。材料亦可以液態氮急速冷卻,則組織變得很脆,可以磨得很細,提高抽出率,且可防止酵素活性喪失。注意有些材料不能研磨過度,以免細胞破得太碎。 均質用的緩衝液体積,通常加入樣本体積的兩倍量以上,以四或五倍為宜,但事先磨成粉末的,有時要加到十倍以上才能均勻懸濁之,當然抽出率會增加,但是伴隨著出來的各種雜質或干擾物質也倍增。可把緩衝液分成二或三次分批抽取,以增加抽出率。 植物材料的均質過程要特別小心,因植物細胞在打破後,會劇烈降低其 pH 值。很多植物材料有含酚化合物phenolic compounds,在空氣中很快氧化成褐色色素,因吸附性強故難以去除。含量較少者可在緩衝液加入 b-mercaptoethanol,降低催化其生成的酵素 phenol oxidase;量多時則以 PVPP (polyvinylpolypyrrolidone) 吸附之 (圖 1.2)。植物本身所含的色素也很難去除,可能會干擾純化步驟。 有些蛋白質附著在細胞壁或細胞膜上,不能以普通水溶性緩衝液溶出,可把材料製成丙酮粉末 (acetone powder),再加入緩衝液時,稍具水溶性的蛋白質就會溶出;但有時須在緩衝液中,加入 界面活性劑 (detergent),溶出嵌在細胞膜中的蛋白質。常用有 sodium deoxycholate 或 Triton,因後者屬非離子性分子,較不影響酵素活性及純化,多使用之。 g. 去除混濁物: 均質後經離心分開可溶與不溶部分,離心無法分開的,再用過濾法,過濾可加助濾劑,如 矽藻土 (celite)。離心後,在上清表面可能會有一層浮皮,多為脂質,可撈掉或以紗布過濾掉。 |
|
| [French press] | |
| [PVPP] | |
| [Membrane protein] | |
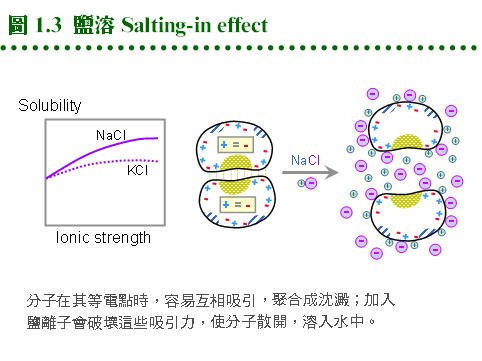
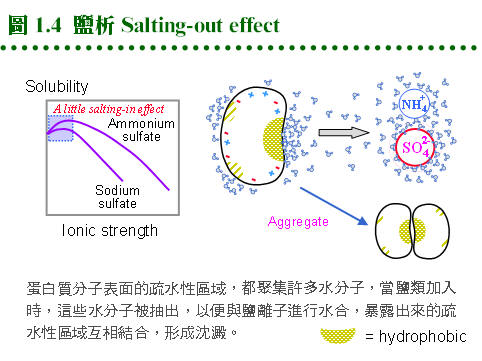
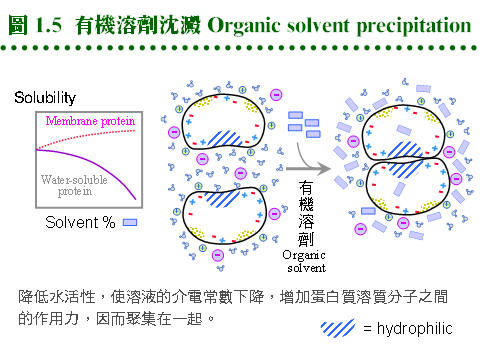
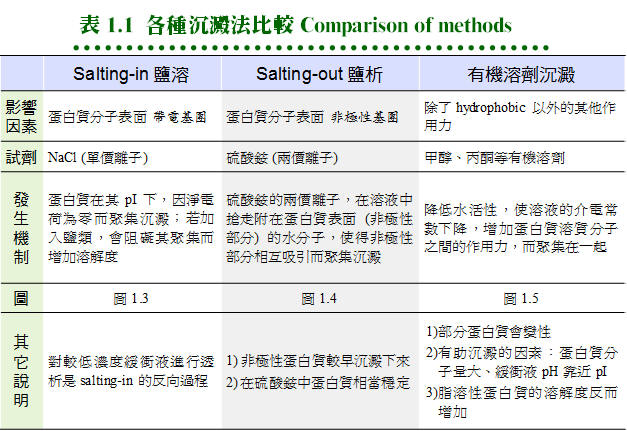
1.4 鹽析及沈澱法:鹽析沉澱法可分離出樣本中的蛋白質,因為蛋白質在水溶液中的 溶解度,會因為溶液中所含鹽類濃度的改變而變化,可利用來沉澱蛋白質。其作用機制是因為蛋白質分子表面電荷的改變,或因分子表面 極性 或 非極性 區域與水分子間作用的結果。 1.4.1 鹽析分劃法︰ 各種蛋白質沈澱方法的原理及應用,在下面各小節以圖解 (圖 1.3, 1.4, 1.5) 說明,並以文字說明整理在本節 (1.4) 最後面的 表 1.1。 1.4.1.1 鹽溶 (salting-in): a. 等電點 (pI) 為蛋白質電荷性質的指標,若緩衝液的 pH 調至此蛋白質的 pI,則蛋白質分子的淨電荷為零,分子間的排斥力下降,會凝聚成大粒子沉澱下來。此時若增加緩衝液的離子濃度 (如加入 NaCl),則蛋白質的溶解度會漸漸上升,稱為 鹽溶。 b. 可能是所加入的鹽類離子包圍了蛋白質表面,與分子上的帶電基團或極性區域作用,進而增加水合效果所造成。 c. 利用這種蛋白質在其 pI 沉澱的特性,把蛋白質溶液調到特定 pI,就可沈澱目標酵素 (當然其他相同 pI 的蛋白質也會一起沈澱下來)。需注意有些酵素在 pI 沉澱後,就不容易溶解回來,因此使用緩衝液也儘量避開目標蛋白質的 pI,以免溶解度變差而沈澱。 1.4.1.2 鹽析 (salting-out): a. 蛋白質分子表面上 非極性區 附近的水分子,被迫滯留在此區域附近,好像附上一層親水性薄膜,藉此把蛋白質分子溶入水中。 b. 若外加入大量離子 (如硫酸銨),則這些滯留的水分子會被抽出,與新加入的大量離子產生水合,因而暴露出蛋白質上的非極性區,這些蛋白質分子之間,因此必須以非極性基團互相結合,聚集成較大的沉澱粒子,稱為 鹽析。 1.4.1.3 硫酸銨 (ammonium sulfate): a. 硫酸銨是一中性鹽,對蛋白質有相當好的安定作用。又因為其離子容積較大,吸走水分子的能力也很強,成為有效的鹽析工具。 b. 硫酸銨的添加是以 百分飽和度 來表示 (不是濃度百分比 w/v),例如大部分蛋白質可在 80% 硫酸銨飽和度下沉澱。因為硫酸銨加入的体積很大,會改變最後的總体積,很難由濃度百分比來計算,因此使用百分飽和度 (% saturation) 作為沈澱蛋白質的度量。 c. 飽和度隨溫度變化稍有差異,25℃ 下的飽和濃度為 4.1 M,即每公升加入 767 克固体硫酸銨;0~100% 之間各飽和度的添加量要查表,而不是以 767 克直接乘以百分比 (%)。 d. 各種蛋白質,因其表面的非極性區域分佈不同,可以在其特定的硫酸銨飽和濃度下沉澱,一般做為最初步的純化方法,同時也可除去其他可溶物質,如核酸、醣類等。 1.4.1.4 如何使用硫酸銨: a. 硫酸銨很容易吸收空氣中的水分而結塊,因此使用前要先把硫酸銨磨碎,平鋪在烤箱內 (約 60℃) 烘過,但小心切勿過熱。 b. 添加硫酸銨時,要在冰浴中進行,不可一次把硫酸銨全部倒入,而是以小量分多次慢慢溶入,並不時攪拌,以免造成硫酸銨局部濃度過高。待硫酸銨全部加完後,再攪拌約 10~30 min,使溶解完全平衡,然後進行離心,注意所要的目標是沉澱或上清,要弄清楚! c. 最後所得的沉澱溶解在最少量的緩衝液中,或直接以沉澱形式保存,均相當安定。但要小心其中所含的硫酸銨,對下一步檢定或純化是否有影響,有必要可以透析法除去之。 1.4.2 有機溶劑沉澱法︰ 1.4.2.1 降低水活性: 若在蛋白質水溶液中加入有機溶液,如丙酮或乙醇,因為稀釋了水濃度而降低水活性,則蛋白質上親水性區域的水合度降低,開始聚集在一起產生沉澱。也可看作有機溶劑降低溶液的介電常數,使蛋白質的溶解度降低。應當注意,有些細胞膜上的蛋白質,若本身含有很多疏水性區,則反而更容易溶入有機溶劑中。 1.4.2.2 使用有機溶劑: 要先把有機溶劑的溫度降至零度左右,緩緩加到蛋白質溶液中,並一邊攪拌使生沉澱。以丙酮為例,大多以 20~50% (v/v) 濃度來沉澱蛋白質,注意其中的 v/v 乃指加入前的体積比,因丙酮與水混合後,体積會稍微縮小。溶液中若有高濃度鹽類,則會影響沉澱行為,以 0.05~0.2 M 離子強度為限。 1.4.2.3 沉澱收集: 此法所得到的沉澱粒子較大也較重,以重力沉降即可收得沉澱,但一般仍以離心收集,可增加回收並去除丙酮。蛋白質沉澱可涼乾,或放到布氏漏斗中,以少量乙醚洗過吹乾製成粉末,如此所得蛋白質所含有機溶液不多,通常不影響下一步驟。 1.4.3 其它處理法: 1.4.3.1 Polyethylene glycol (PEG): a. PEG 是一種水溶性的高分子聚合物,分子量 4,000 以上的 PEG 可以用來沉澱蛋白質,其作用原理類似有機溶液,但使用濃度較低。 b. 較麻煩的是 PEG 不易由蛋白質沉澱中除去 (分子量不小且無揮發性),幸而 PEG 通常不會影響下一步純化步驟。 1.4.3.2 去除核酸及多醣: a. 樣本溶液中若有大量核酸,可以加 protamine sulfate 與之產生沉澱,再以離心去除之。這是利用 protamine 上的正電荷,與核酸的負電結合,聚合成較大複合物而沈澱。 b. 碳水化合物較難完全分離,通常期望在蛋白質沉澱時,或往後的層析法能去除之。核酸與多醣都可以用專一性水解酶進行酵素分解,但價錢較昂貴。 1.4.3.3 特殊處理法: 有些較特別的酵素,具有相當特殊的性質,可利用來純化。例如 RNase 對熱非常安定,可耐到 100℃,因此可把粗酵素液加熱煮沸,除去其它蛋白質。對強酸、強鹼或有機溶劑的特殊安定性,亦可利用之。使用這些嚴苛的處理方法時,要特別小心考慮環境傷害。 (每張圖表均連結有 960 x 720 清晰版本) |
|
|
{等電點} |
|
|
[鹽 析] |
|
| [Ammonium sulfate precipitation] | |
|
|
|
| [PEG] | |
問題集 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 純化某甘藷塊根中的蛋白質,由粗蛋白經純化 100 倍後可達到均質,活性回收率約有 50%,如何略估此蛋白質在原來的甘藷材料中,佔有多少百分比? [1] 2. 若蛋白質分子表面幾乎沒有疏水性胺基酸,則它容不容易被 salting-out 出來? [2] 3. 為何蛋白質變性後容易在水溶液中沉澱下來? [2] 4. 為何硫酸銨沉澱是以百分飽和度來計量,而非以重量或体積百分比?[3] 5. Salting-out 的相反程序是否為 salting-in? [3] 6. 蛋白質樣本溶液使用較低離子濃度的緩衝液透析,可否視為 salting-in 的相反程序?[3] 7. 在純化過程中,經過硫酸銨分劃後,發現比活性僅增加為 1.05 倍,則此一純化步驟有無存在必要?請解釋為何。 [2] 8. 使用有機溶劑沉澱蛋白質,比之鹽析分劃有何優缺點? [2] 9. 能否用純水去溶解蛋白質?說明為何? [2] 10. 用有機溶劑沉澱蛋白質時,為何要在低溫下進行? [1] 11. 植物細胞比動物細胞要更難以處理,請問植物細胞是有那些特殊問題? [1] 12. 植物細胞在打破之後,其抽出液很容易變成褐色,其原因何在?如何防止? [1] 13. 用 PEG 4000 可以把蛋白質沉澱下來,但接著你如何除去這些 PEG? [2] 14. 為何硫酸銨是一種中性鹽類,而非酸性物質? [2] 15. 為何蛋白質在硫酸銨的沉澱中保存會比較穩定? [3] 16. 加硫酸銨進行鹽析時,若把預定加入的硫酸銨固体一次全部倒進蛋白質溶液中,而非慢慢加入,將會發生什麼問題? [3] 17. 硫酸銨分劃時,各分劃的酵素分佈通常是以其總活性來評量,而非使用比活性,請說明為何。[4] 18. 用有機溶劑沉澱蛋白質時,為何會產生熱量? [3] 19. NaCl 或 KCl 會使蛋白質在水溶液中的溶解度上升,而硫酸銨或硫酸鈉反而會使蛋白質溶解度下降,為何兩種鹽類會造成這樣的差異? [4] 20. 通常在純化核酸時,較麻煩的干擾物質不是蛋白質,而是多醣類,很不容易完全去除之,請以化學構造的觀點說明之。 [5] 21. 蛋白酶可略分成四大類,請分別說明其作用機制如何。並請列出每一類的抑制劑。[2] 22. 有一位研究生經常要做免疫球蛋白的簡單分離與純化,他一直在實驗桌上放了一瓶硫酸銨溶液,雖然說是水溶液,但硫酸銨固体卻因過飽合而結晶在瓶底,且結晶數量不少。每次要做硫酸銨分劃時,只要加入與樣本同体積的這種硫酸銨溶液 (上清部份),就可以把抗体沉澱下來。請問他這種做法適當嗎?有何應該注意之處? [4*] 23. 其實平日的濾泡式咖啡,就是一種生化實驗的抽取過程。先把咖啡豆用研磨機磨成細粉,磨得太粗或太細,都會影響咖啡的風味,另外要注意的條件有:(1) 熱水的溫度、(2) 熱水的最適量、(3) 冷泡咖啡的特點、(4) 過濾的時間、(5) 濾紙摺法與濾器形狀、(6) 過濾時是否攪拌、(7) 過濾的方式 (一次濾完或分次?),都有其講究與所根據的生化學原理。請以泡咖啡觀察心得,整理出在進行抽取實驗時,應該注意的事項。[5*] [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
| ▲ |