|
酵素純化 Enzyme Purification 4 純化策略 Purification Strategy |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
4.1 純化步驟設計 4.2 純化結果 |
|
下載 [內文 pdf] [投影片 pdf] [影音檔 mp4] {BCbasic} 連結生物化學基礎
|
|
想辦法由一堆蛋白質中純化出目標酵素 |
|||
|
4 純化策略 |
參考資源 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
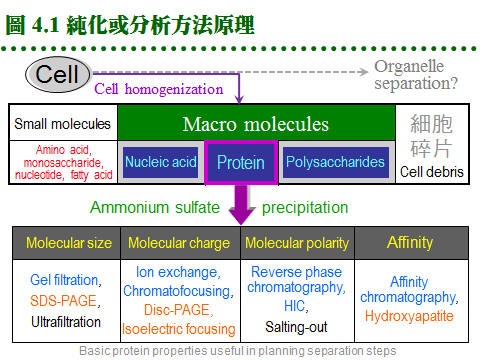
正確的純化策略極為重要,往往可以使純化達到事半功倍之效,因此事前要有極為充分的準備與規劃過程。但有時對目標酵素所知甚少,就要一步一步嘗試,像是摸著石頭過河,小心追蹤每一個步驟回收多少酵素活性?4.1 純化步驟設計:4.1.1 影響純化的因素: 設計純化步驟時,要考慮 Recovery (高回收率), Resolution (高比活性、高純度), Speed (方便與快速), Capacity (經濟) 四個因素。 a. 高回收率: 一般指總活性的回收,最終回收率若低於 30% 就得檢討過程是否有問題。 b. 高比活性: 酵素的 比活性 要能夠顯著提高,最終純化成品與原始粗抽液二者間,其比活性之比值稱為 純化倍率(purification fold)。各種酵素因材料來源及含量多寡不一,純化倍率也有高低,不過就同一樣本而言,當然越高越好。 c. 高純度: 純度 與 活性 是酵素純化的兩大目的,以達到均質酵素為最終目標;相對而言,在電泳上看不到其它雜質,即可視為均質,但也只能說是 electrophoretically pure。絕對均質的酵素幾乎是不可能,我們只能達到相對純度。 d. 方便與快速: 方法要儘量簡便,步驟勿拖太久,因為酵素活性會隨著操作時間而急速降低,尤其對較不穩定的酵素,時間是最重要因素,有時不得不犧牲其它要求。 e. 經濟: 許多試劑相當昂貴 (尤其是活性分析用藥),大量使用時要考慮到經濟問題,因此每次操作所能處理的樣本量也是關鍵。 4.1.2 組合純化步驟: a. 組合標準: (1) 已知的酵素,可先依照已發表論文的步驟進行,有問題再作改進。通常都是以 硫酸銨分劃-膠体過濾-離子交換 為骨幹,再加上其它方法,組成全部流程。 (2) 對完全未知的酵素,亦可循此骨幹先試行純化,視其結果如何再加改進。 (3) 不要忘記利用該酵素的特殊性質來純化,例如在其 pI 沉澱、特別的疏水性、有專一的抑制劑,或異常的熱穩定性等。 b. 純化方法分類: (1) 每種純化方法都是利用蛋白質分子的某種特性來分離的,圖 4.1 把所有的純化方法,依其運用特性分類歸納,以作為設計流程時的參考。 (2) 通常同一種純化方法不會重複使用,最好是交叉利用各種蛋白質的不同性質,來設計一連串的純化步驟 (每張圖表均連結有 960 x 720 清晰版本)
|
[History] "Urease could be isolated and crystallized" (The chemical nature of an enzyme)
(PubMed) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
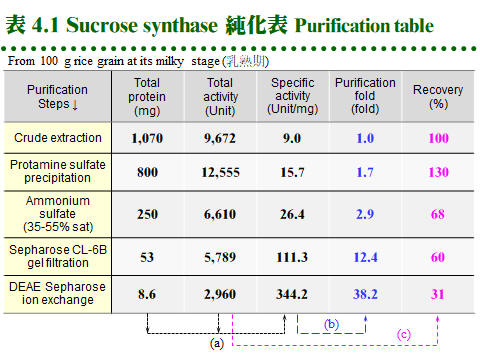
4.2 純化結果:最終純化結果以 純化表 (purification table) 摘要整個過程及成效,例如表 4.1 所示。總活性除以總蛋白質量就是 比活性 (specific activity),請參考表 4.1 下方 (a) 的算法指引。比活性逐漸增加的比數即為 純化倍數 (purification fold) (b),而以粗抽取液所含活性為 100%,每個步驟所收到的總活性百分比,稱為 回收率 (recovery) (c)。 若回收率超過 100% 時,表示粗抽取液中可能含有酵素之 抑制因子,或含有干擾活性分析的物質,經去除後酵素活性大增。若回收顯著偏低,表示此一純化步驟並不理想,應探討緩衝液、溶離液成分有無問題,或者是純化流程設計是否不良。有時候目標酵素根本沒有從材料中被有效抽取出來,一開始的收率就很低,就要檢討萃取過程。 如上表所純化得到的酵素,以電泳檢定已達相當純度,應可供大多數生化學實驗需要,若有必要,可再經製備式電泳或其它方法純化。請注意並非所有的實驗都必要使用均質酵素,有很多實驗 (如酵素動力學、分子量測定) 都不需要完全均質的蛋白質。
|
"Don't waste clean thoughts on dirty enzymes"
(PubMed) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
應用問題 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 以下是某研究生甲純化酵素 A 的過程概述: 甲的最終目標,是要從植物的癒創組織中純化酵素 A。當收集得足夠量的癒創組織後,加入適量緩衝液 (1 mM Tris-HCl, pH 7.0),以研砵進行研磨,因為怕酵素失去活性,儘快離心收集得 100 mL 上清,進行下一步驟。很快加入 50 g 硫酸銨,使達到 50% 飽和度,得上凊約 40 mL;再加入 25 g 硫酸銨,使成為 75% 飽和度,離心取沉澱,這是依照前人研究報告取 50-75% 飽和度的硫酸銨沈澱。溶解在 5 mL 緩衝液後,通入 DEAE-Sepharose 管柱中,據文獻說酵素 A 可被陰離子交換介質結合。膠体已平衡在緩衝液,裝填在 1.6 × 60 cm 的玻璃管柱。樣本通入後,以緩衝液洗過數個管柱体積,開始拉 0~0.5 M NaCl 濃度梯度,並同時收集流出液。很奇怪,發現蛋白質幾乎都不見了,溶離圖譜也沒有明顯的蛋白質尖峰。只得重新抽取,再用硫酸銨沉澱後,改以膠体過濾法分離之,這次用 2.6 × 50 cm 管柱,使用 Sephadex G-50 膠体。結果出現一個大的蛋白質峰,也有酵素 A 活性,甚是高興。趕緊做 disc-PAGE 及 SDS-PAGE,結果發現膠体過濾法前後的蛋白質電泳圖譜,都差不多。算一算總活性回收量,也不到文獻報告的十分之一。請指出甲生可能造成的所有錯誤,並幫他設計一個可行的純化流程。 [4*] 2. 某蛋白質 B 在不同的緩衝液下,會有不同的四級構造 (如下式),且這種轉變是可逆的。 aabb (緩衝液甲) → ab + ab (緩衝液乙) (1) 請解釋此一現象發生的可能原因。 (2) 請利用這個特性,設計一個層析法來純化蛋白質 B。 [3] 3. 動物的血清白蛋白 (albumin) 經過蛋白質水解處理後,成為胺基酸混合液,可供醫療上針劑使用。但若水解不完全,可能有分子量較大的胜肽片段,打入人体後會產生抗体,相當危險。且白蛋白中經常有多醣類雜夾其中,無法被蛋白質水解酶水解,分子量很大,可能是更危險的抗原。請問有那些方法,可以有效的除去這些有害的物質,同時可大量處理,以便大量製得,供醫療上使用? [3*] 4. 蛋白質 C 及 D 的分子量分別為 49,000 及 47,000,但是 C 分子中含有 70% a helix,在 pH 8.8 下其 helix 構造會變性而成為 random coil,但仍保持其水溶性,當 pH 調回中性時回復原態;蛋白質 D 在兩種 pH 下均為原態。請設計一個方法,可分離此二蛋白質。[4] 5. 經過部分純化的酵素 E,在緩衝液中為清澈溶液,在水中透析三日後發現: a. 透析袋內有沉澱發生,離心後分別收集上清及沉澱,上清活性剩約五分之一,沉澱及外液則均無酵素活性。 b. 上述透析袋內的上清及沉澱,測蛋白質量,總共只有原來透析前的一半。 c. SDS-PAGE 顯示透析外液不含蛋白質,但有 Ninhydrin 反應及 280 nm 吸光。 請問: (1) 為何會產生沉澱? (2) 總酵素活性為何下降許多?列出所有可能情形。 (3) 袋內蛋白質量只剩一半,請作一假設並推測原因。 (4) 請設計一個實驗,證明你的假設。 [4]
6. Lectin
是植物的一類特殊功能蛋白質,可與各種醣類分子產生專一性的結合。有一 lectin F,它與葡萄糖有相當專一性的結合,請問你如何以最簡單的層析方法來純化之?
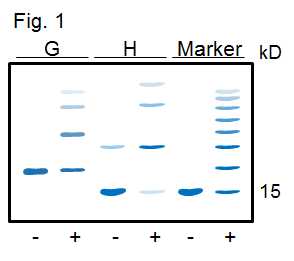
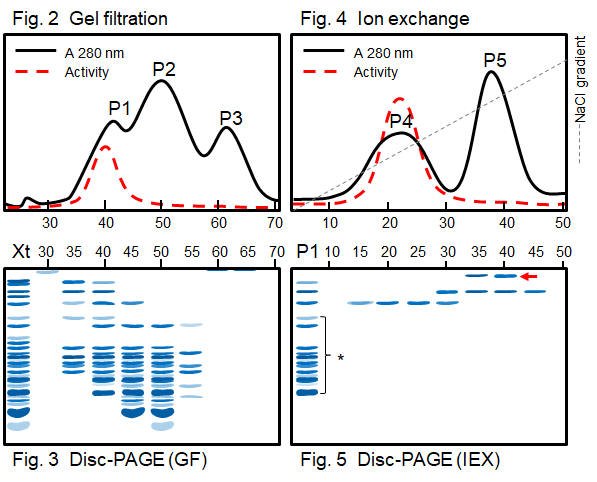
[3] 7. 蛋白質間可以用架橋分子連在一起,成為二元体、三元体或多元体。現有 G, H 兩蛋白質,架橋反應後以 SDS-PAGE 檢定之,得如 Fig. 1 結果。 +:蛋白質經過架橋處理 -:未經架橋處理之蛋白質 Marker:已知之蛋白質 (分子量 15,000) 經架橋處理後,所得之各種聚合物 另以膠体過濾法測 G 及 H 的分子量,二者均為 90 kD。 請由這些結果,推論 G 及 H 兩蛋白質的四級構造。 [4] 8. 酵素 I 的純化流程如下: ↓ 加緩衝液均質化 粗抽取步驟 (依一般方法進行) ↓ 離心 上清 ↓ 0.3~0.5 飽和度硫酸銨分劃 Crude I (酵素粗抽液 Xt) ↓ 膠体過濾 (Sepharose CL-6B) 溶離得 P1, P2, P3 三尖峰 (Fig. 2) ↓ → 電泳 (Fig. 3) disc-PAGE Peak P1 (只有 P1 有酵素活性) ↓ 離子交換 (DEAE-Sepharose) ↓ 以緩衝液洗過一個管柱体積 ↓ 0~0.3 M NaCl 梯度溶離 ↓ Fig 4 得 P4, P5 兩個尖峰 ↓ → Fig. 5 各分劃做 disc-PAGE Peak P4 (只有 P4 有酵素活性)
請問: (1) Fig. 2 上 P3 的各分劃 (#55~65),在電泳 Fig. 3 上幾乎都不見了,請解釋為何。 (2) P1 本有一些雜質 (Fig. 5 中打 * 處),但經過離子交換之後,在 0~0.3 M 梯度收得的各分劃,以電泳檢視時 (Fig. 5),找不到這些色帶,它們可能在那裡? (3) Fig. 5 中 #35, 40 多出現一個高分子量色帶 (箭頭處),可能是如何產生的? (4) 你對這樣的純化結果滿意嗎?請再改進以上的純化步驟。 [5*] 9. 某蛋白質樣本通入 DEAE-離子交換介質,以純化其中的酵素 J,樣本中原含有 50 mg 蛋白質及 100 活性單位酵素 J。以 0~0.3 M NaCl 梯度溶離得數個 280 nm 尖峰,依次標以 P1, P2, P3, P4 及 P5,分別收集之,分析均無任何酵素 J 活性。另外測得以下結果: a. 各蛋白質峰的蛋白質總量為 46 mg。 b. 當混合 P2 及 P5 後,可測得約 280 單位酵素 J 活性,其它的混合均無活性。 c. 當混合 P2, P4 及 P5 後,只測得 98 單位的酵素 J 活性。 d. 測 P5 的蛋白質含量只有 0.5 mg。 請問:P2, P4 及 P5 分別含有何種物質? [4]
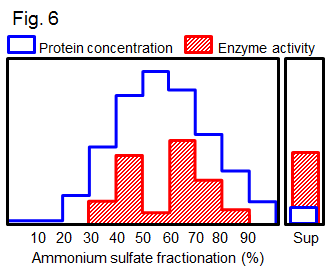
10. 某酵素
K 的活性分析方法如下,L
為其耦合反應酵素,使用 NAD+ 為輔酶。
在進行硫酸銨分劃後,得到 Fig. 6 的結果。 請問: (1) 活性分析結果有兩個 K 的活性尖峰,可能的原因為何? (至少列出兩種假設) (2) 請設計實驗,分別可以證實上題假設。 (3) 若把硫酸銨 30~80% 飽和度間的部分收集起來,再進行膠体過濾,結果 K 的活性回收率多達 250%,則那一個假設為真? (4) 上清蛋白質量不多,但出現相當高的活性,是何原因?請設計實驗證明你的假設。 [5*] 11. M 為一相當不穩定的酵素,尤其在低 pH 下容易變性,乙、丙、丁三人以親和層析法純化之,他們的實驗設計如下: 將 M 的基質衍生物 N 耦合到某種親和擔体,洗去反應液後,把擔体裝入管柱,然後通入部分純化的 M,再用游離的 N 溶離下 M。三人的實驗條件略有不同: 所用親和擔体: 耦合緩衝液: 溶離條件: [乙] CNBr-Sepharose Tris pH 8.0 游離型 N [丙] Agarose-C6-COOH 磷酸 pH 7.5 游離型 N → pH 2.05 甲酸 [丁] CNBr-Sepharose 磷酸 pH 7.5 游離型 N → pH 2.05 甲酸 → NaOH pH 12 所得結果也有相當的差異: [乙] 發現 N 根本沒有耦合到擔体上,酵素 M 無法結合上去。 [丙] 酵素 M 很難溶離下來,要使用 pH 2.05 的劇烈條件,才能洗下蛋白質。 [丁] 酵素 M 是被結合到擔体上了,但無論用何種方法均溶離不下來。 請問: (1) N 分子上一定要有何種官能基團,以便三人能夠順利完成耦合反應? (2) 乙在實驗中所犯的毛病為何?如何改善? (3) 丙可能是用什麼試劑把 N 連結到 agarose 上? (4) 丙的實驗中何處不妥?如何改善? (5) 丙所溶離下來的酵素 M,容不容易得到均質?其活性如何? (6) 丁為何無法把 M 溶離下來?M 與丁的膠體之間可能發生什麼情況? (7) 三人都忽略了一個重要步驟,此步驟是什麼?應當如何進行? [5] 12. 有 P, Q, R, S, T 五種大小分子的混合物,其性質如下表,請設計一系統方法純化之。 [4]
13. 酵素 U 需要鎂離子共同維持活性,在純化過程中,膠体過濾法或離子交換法均使得 U 失去活性,請分別解釋原因;並說明如何防止之? [3]
14. 有兩種蛋白質
V 與 W,其
pI 分別為 5.2 及 6.3,原態單元体之分子量分別為 32,000 及 35,000。V 在其 pI 的環境下,有 90%
的分子會發生聚合現象,成為四元体,且可溶於一般緩衝液。請設計一簡單方法,分離此二蛋白質的混合物。 [4]
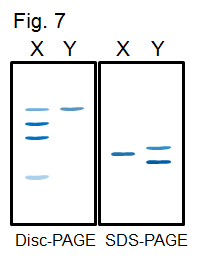
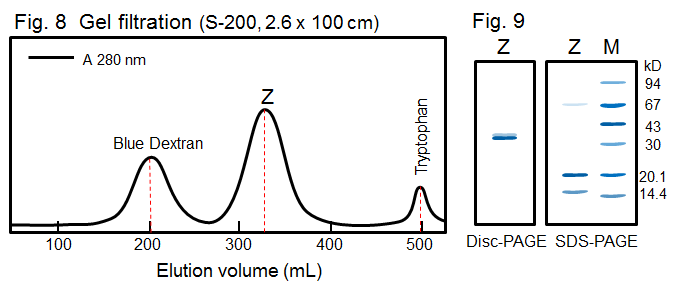
15. 經純化後之蛋白質 X 及 Y,以 PAGE 電泳檢定得如 Fig. 7。請分別討論蛋白質 X 及 Y 何者為純質?解釋為何。 [5] (請由所得之電泳圖形說明之,並再設計實驗證明) 16. 某蛋白質只知有下列性質,請設計一流程純化之。 a. 原態分子量約 20 kD b. 等電點 8.0 c. 可催化生成葡萄糖 d. 在高溫 (95℃) 下可耐受 20 min 而活性不失 e. 尚未誘導出其專一性抗体 [4] 17. 蛋白質 Z 的純化過程中,最後得到如 Fig. 8 及 Fig. 9 的結果,並且做了膠体過濾管柱的分子量校正 (如右下表 column calibration, Kav = Ve -Vt/Vo-Vt)。
請問: (1) 此膠体過濾管柱的 Vo 及 Vt 各為若干? (2) Z 的 Ve 為多少?請依此定出 Z 的原態分子量。 (3) 請由 Fig. 9 推出 Z 分子的四級構造。 (4) 請討論 Z 是否為純質? [4]
18. 某粗抽取液中各種蛋白質及酵素 AA 的性質如下表,請依指示進行以下的純化步驟: (1) 粗抽液進行膠体過濾法 (Sepharose CL-6B),預測並畫出層析圖譜及 SDS 電泳結果。 (2) 取出含 AA 部份,接著進行離子交換法 (DEAE Sephacel, pH 6.5),同上預測結果。 (3) 若你覺得 AA 還不夠純,請自行設計進一步的純化方法,並預測其結果。 (以上的 SDS-PAGE 只要做含有最高 AA 的一管即可,不需跑全部分劃) [5]
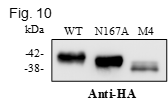
19. 若你在一個熱帶窮困國家的醫院裡工作,沒有任何儀器也沒有電力,只有簡單的玻璃管及小孔徑的塑膠注射針筒等器材;少數藥品之一是胃藥,這種胃藥是氫氧化鋁制酸劑,可保護胃壁,另外有一些牙科的填充骨粉。某日你發現當地有一種植物果實的抽取液可以抗癌,這種果實中大都為糖份,但含有一點點苦味物質,可能是生物鹼。你想研究何者是真正有效的成份,在這種艱難情況下,請問你如何粗略分離其中的成份? [5] 20. 禽流感病毒 (AIV) 外殼有一種血液凝集素 (hemagglutinin, HA),是入侵宿主細胞的關鍵分子,HA 與宿主細胞膜上的接受體結合,接著啟動一連串機制,把病毒基因送進細胞內,開始病毒的感染、繁殖、擴散生活史。HA 在宿主體內被切開成為 HA1 及 HA2 兩部分才有正常功能,但仍然維持其立體構造;另外 HA 也會被醣化 (glycosylated),可能有保護病毒的功能。以 H6N1 (2838V) 的 HA1 為例,從其胺基酸序列預測,有數個 Asn 醣化位置,若把某個醣化位置的 Asn 突變成 Ala (Fig. 10, N167A),則 HA1 分子量下降,最右側的 M4 分子量約 38 kDa,請問 M4 可能是什麼?可以推得什麼事實? [4*]
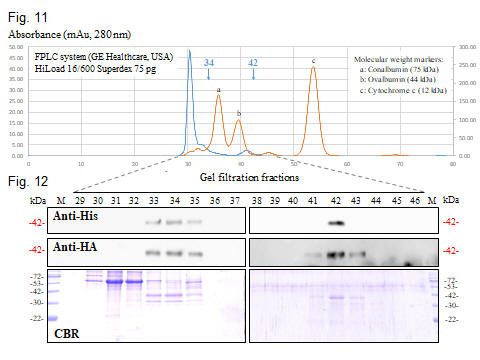
承上,若把 WT 的 HA1 分離出來,然後進行膠体過濾純化,則得如 Fig. 11 的色析圖譜,但是必須以 SDS-PAGE 及 Western blotting 才能看到 HA1 (Fig. 12),請問所得到的 HA1 的分子量若干?能否推知 HA1 的分子構造? [5] 21. 請解釋下列各操作時所發生現象的主要原因,若是實驗操作問題請亦提出解決方法: 例:加熱使酵素中止反應。[答] 蛋白質受熱變性,構形被破壞,失去活性。 (a) 粗抽取液經透析後,總活性降至一半以下。 [4] (b) 粗抽取液經透析後,總活性增加 50%。 [3] (c) 硫酸銨沉澱後,找不到酵素活性。 [4] (d) 硫酸銨分劃後,某酵素的活性分佈在所有的各個分劃。 [5] (e) 有人宣稱使用 SDS-PAGE 可以測得原態蛋白質的分子量。 [5] (f) 蛋白質樣本在濾紙電泳上會有嚴重拖尾現象。 [4] (g) 有些人使用酵素的粗抽取液即可進行動力學實驗。 [4] (h) 已知某酵素不是醣蛋白,卻可以糖染色法 (PAS) 染上色。 [5] (i) 用 ultrafiltration 濃縮後的濃縮液中,發現根本沒有濃縮效果。 [4] (j) 進行甘藷粗抽液的原態電泳,經活性碘染色發現有粉紅色色帶。 [4] (k) 酵素經過反相層析法 (reversed phase chromatography) 後,活性立刻消失。[5] (l) 等電焦集法膠体可形成 pH 梯度。 [4] (m) 原態電泳時,所要的蛋白質跑不下來,在膠体上方拖成一片。 [3] [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ▲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ▲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ▲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
> 酵素分析 |
▲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||