|
酵素純化 Enzyme Analysis 6 酵素活性測定 Enzyme Activity Assay |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
6.1 催化反應 6.2 酵素活性分析 6.3 維持酵素活性 |
一種酵素 (PCS) 的活性區 |
下載 [內文 pdf] [投影片 pdf] {BCbasic} 連結生物化學基礎
|
|
6 酵素活性測定 |
參考資源 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
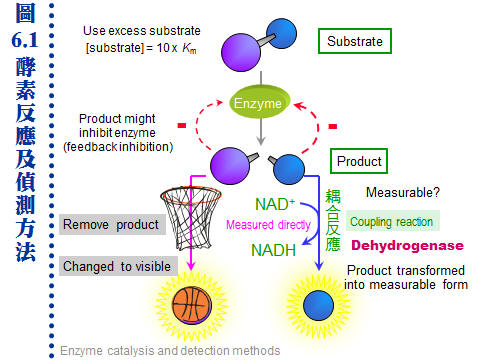
6.1 催化反應:a. 反應設計原則: 大部分酵素反應方式,都可包括在圖 6.1 的大綱中。建立酵素活性測定步驟時,請注意以下原則︰ (1) 測定生成物的產生量,比測基質 (反應物) 的消失量,更方便且靈敏。除非不得已,儘量避免測定反應物。 (2) 反應流程儘量簡單,太複雜的操作過程,增加工作量及成本,且容易造成失誤。 (3) 複雜的反應,可能產生某些意外的生成物 (或 pH 改變),回饋抑制酵素反應 (圖 6.1 中以負號表示)。 (4) 反應條件必須有利於指定反應方向,可以移除生成物 (以籃框表示) 或連上耦合反應。 (5) 小心樣本中有無其他酵素 (或抑制劑) 干擾,會因為消耗反應物或生成物,加強或減弱目標酵素的活性,造成假象而誤判。 (每張圖均連結有 960 x 720 清晰版本) b. 反應基質及酵素濃度: 在試管中進行的酵素活性分析,與生物体內的酵素反應,有相當差距。為使反應達最大活性 (Vmax),或往指定方向進行,所使用基質濃度為十倍 Km。反應的最適 pH、溫度、時間等條件,均需以實驗求得,尤其酵素的用量影響結果甚鉅,要事先找出最適當的使用濃度。 c. 不要忘了基本的酵素動力學: 本課程的主旨是在探討酵素的純化技術與分析方法,對於酵素的催化行為以及所衍生的基礎知識,並沒有討論很多。 但是,不要忘了後者才是研究酵素的最終目的,由簡單的動力學分析,就可以得知許多酵素與其基質間的作用關係,以及酵素催化的分子機制,請務必要体會這一點提醒,也要隨時回顧基本的酵素動力學。 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
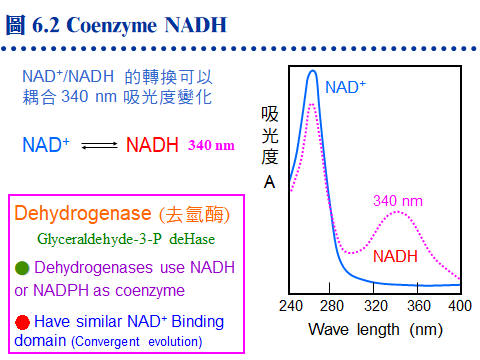
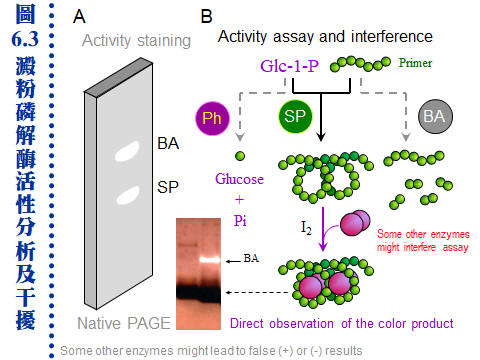
6.2 酵素活性分析:酵素活性的偵測,通常是固定在一段 時間 (t) 內,觀察 生成物 的產量 (P)。因此反應進行一定時間後需中止反應,再進行生成物的定量。而 P/t 即為此酵素的 反應速率 (vo),也就是酵素活性。但若可以連續記錄反應過程,則有無中止反應並不重要。 6.2.1 酵素活性測定方法: 反應一段時間 (t) 後中止反應,測生成物量 (P) 即得活性 (P/t)。以下為各種測定生成物的方法,任何物理、化學甚或生物方法都可使用。 a. 直接測定生成物: 所有去氫酶均可測定 NAD+ 與 NADH 間的變化量,即為去氫酶的活性。例如 酒精去氫酶 催化下式之正反向反應: Ethanol + NAD+ → Acetaldehyde + NADH + H+ 反應液中 NADH 在 340 nm 波長有吸光變化 (如圖 6.2)。 b. 耦合反應法: 若生成物 (P) 無法直接測得,設法把生成物再進行耦合反應,變成可測量的產物 (Q)。很多酵素可耦合到上述去氫酶的反應,則可測 340 nm 波長變化。 S → P → Q c. 化學測定法: 若生成物具有化學活性,則可直接進行化學反應,例如蔗糖以 轉化酶 (invertase, IT) 水解成果糖及葡萄糖,兩個單糖產物都是還原糖,可測定所生成還原糖之還原力。 d. 放射線測定法: 若基質分子中含放射性核種,酵素反應後追蹤生成物的放射線量,即可知酵素活性。麻煩的是,要分離開反應物及生成物,有時不太容易,可用 HPLC、濾紙色析法 (PPC) 或離子交換法等。 e. 測壓法 (manometry): 若生成物為氣体,則可測定氣体体積之增加量。尤其有氧氣生成時,可用 Warburg 氏呼吸計測之。 f. 電極︰ 有些電極可直接測定反應的變化,例如若有 pH 或氧濃度的改變,則可用 pH 計或氧電極。酵素電極把酵素固定在薄膜上進行反應,然後直接測定反應物的改變,相當方便,但多用在工業或醫療界有大量樣本時。 g. HPLC 檢定法: 若產物無法以其他任何方便的方法檢測時,最終可用 HPLC 來分析產物,但相當費時且需要較昂貴的設備。 6.2.2 中止酵素反應方法: 注意任何中止反應的方法均不得破壞生成物,或干擾儀器測定。 (1) 最常用急速加熱 (100℃ 水浴) 10 min,注意有些蛋白質 (如 RNase) 仍然無恙。 (2) 以 3~5% TCA (三氯乙酸) 改變 pH,使酵素變性沉澱,再離心去除沉澱取上清。 (3) 用 1% SDS 中止反應,注意 protease K 等在 SDS 下仍有活性。 (4) 若該酵素需二價離子,則加入 EDTA 中止反應。 (5) 若該酵素有專一性抑制劑,則可加入抑制劑。 (6) 若使用放射性基質,可加入大量不具放射性 (cold) 的基質,看來具有放射性的生成物不再產生了,但實際上酵素反應並沒有停止。 6.2.3 連續測定法 (continuous-reaction): 連續測定法可不用刻意中止酵素反應,但通常要使用儀器即時監控生成物。 a. 連續測定法: 若酵素反應,在其反應過程中可以一邊進行觀察,則可連續測定反應的情形,不須中止反應,上述 酒精去氫酶 即可連續監視 340 nm 波長的變化。若生成物無法直接觀測,也可連接某一耦合反應,把生成物轉變為容易觀察的物質。 b. 連續的耦合反應: 耦合反應在連續測定法應用相當多,但由於耦合反應更複雜,甚至成為一個迷你的代謝途徑。這種複雜的反應中有較多試劑與產物,許多不必要的副反應可能出現,干擾反應結果,因此要作好對照的控制組,以免有假結果出現。 6.2.4 澱粉磷解酶活性分析: 以澱粉磷解酶 (starch phosphorylase, SP; EC 2.4.1.1) 為例,說明如何以生物化學方法偵測其活性,並提醒活性分析如何受其他物質干擾而造成假象。 a. 澱粉磷解與合成: 注意磷解 (加磷酸分解) 不是水解 (加水分解),此反應為可逆 (Pi 為無機磷): (Glc)n-Glc + Pi → (Glc)n + Glc-1-P (磷解方向) (Glc)n + Glc-1-P → (Glc)n-Glc + Pi (合成方向) 合成方向反應可測無機磷 (Pi) 生成,而 Pi 的檢定有方便的化學呈色反應。反之,磷解方向應如何設計方便的活性分析方法? b. 延長澱粉鏈: 澱粉磷解酶以可溶性澱粉 (Glc)n 作為 引子 (primer),催化 Glc-1-P 連接到此引子上,成為較長的直鏈澱粉 (amylose),因此可用碘液呈色觀察。在原態電泳膠片,澱粉磷解酶活性可利用此法染色,直接在膠片上看到酵素活性 (如圖 6.3 A)。 c. 小心其它干擾物質: 澱粉磷解酶的兩種基質很容易受到其它酵素的作用:可溶性澱粉受到 b-amylase (BA) 澱粉酶快速水解,澱粉磷解酶活性會被抑制。而 Glc-1-P 受 phosphatase (Ph) 磷酸酶的水解,產生游離的磷酸,會誤判為澱粉磷解酶的活性 (圖 6.3 B)。 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6.3 維持酵素活性:酵素是有活性的分子,因而可能隨時失去活性,應該考慮各種最佳的環境與條件,以便使酵素保持在最安定的狀態,其中酵素的緩衝液是最關鍵的因素。 6.3.1 緩衝液: 緩衝液可維持酵素溶液的恆定酸鹼度及離子濃度,兩者都會影響酵素的活性,請複習生物化學中緩衝液的作用原理。 a. 緩衝液有其使用範圍: 各種緩衝液都有其適用的 pH 範圍,表 6.1 列出常用的緩衝液。 表 6.1 各種常用緩衝液及其使用範圍:
◎ 兩種最常用的緩衝液,注意其使用上的特性。 b. 添加物都有作用: 經常在緩衝液中加入一些物質,以增加酵素安定以保持活性 (表 6.2),要小心這些添加物是否影響活性分析,是否影響下一步實驗。(參考 6.3.3) 表 6.2 緩衝液常用的添加物:
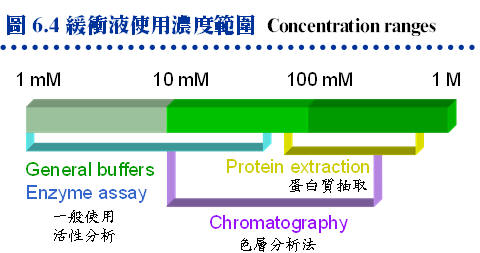
c. 溫度的影響: 緩衝液用來維持溶液恆定 pH,請注意有些緩衝液的 pH 受溫度影響很大 (如 Tris)。故製備緩衝液時,要考慮此緩衝液將要在何種溫度下使用。 d. 濃度的影響: 改變緩衝液的濃度,可能會影響其 pH。使用不同緩衝液,酵素活性表現也會有差異,有些酵素甚至失去活性。通常若環境的 pH 變化較大,則需要使用較濃的緩衝液,圖 6.4 列出各種實驗情況下,緩衝液的使用濃度範圍。 e. Stock solution: 緩衝液可以十倍濃度貯存,高濃度可防止微生物生長,並保持每次實驗所使用藥品的穩定度與一致性。注意在稀釋後,溶液的 pH 也許會有改變,尤其是磷酸緩衝液很容易受到濃度改變而影響其 pH。 6.3.2 試劑的保存: 試劑的適當保存非常重要,要依照廠商所指示的溫度貯存。 a. 避免潮解: 注意每當試劑由冷藏庫取出時,要等它回到室溫後才能打開,否則水氣會附在藥品的表面,進而潮解或破壞之。 b. 分裝凍藏: 常用的冷藏藥品以小量分裝 (aliquot) 後凍藏,是最好的貯藏方式,尤其是溶液狀態的生物活性試劑 (如酵素),切勿反復 凍結-解凍。有些酵素經不起凍藏,一旦結冰後再解凍,活性快速下降 (為什麼?)。例如上述澱粉磷解酶請勿凍藏,放在 4℃ 即可。 c. 甘油凍藏: 於低溫 (-20℃) 貯藏的酵素溶液,若保存在 50% 甘油就不會凍結,隨時取用。但請注意所含的甘油,對下一步反應有無影響。 d. 避光防菌: 很多試劑要避光貯存,或須放在乾燥器中,避免長霉長菌。 6.3.3 酵素活性之維持: a. 酵素的安定性不同: 酵素在細胞中合成後,有的分泌到細胞外,有的運送到細胞器官中貯存或應用。前者 (分泌性酵素) 因為要在細胞外的惡劣環境中生存,因此較為堅韌,不易受到破壞;反之,細胞內的酵素,都以較濃的濃度集中在保護良好的胞器內或胞膜上,一旦抽離細胞暴露在氧氣中,可能很容易失去活性。 b. 酵素失活的原因: 可歸類成如下的物理性或化學性原因。 (1) 蛋白質變性: 離開細胞的生理環境後,蛋白質可能遇到極端的 pH 條件、不適的溫度、冰凍時被冰晶破壞,或使用變性劑 (如 SDS、尿素),均會使蛋白質的構形破壞。 (2) 酵素活性區破壞: 在抽取過程中,若失去 cofactor,或者活性區的關鍵胺基酸被修飾,均可造成。最常見的影響是氧化,尤其是 cysteine上的 -SH 基很容易被氧化。一般加入 EDTA 除去可活化氧分子的二價離子,或加入抗氧化劑以其自身氧化防止 -SH 基氧化。 (3) 蛋白酶水解: 細胞內有許多蛋白酶,細胞被打破後即釋放到酵素溶液中,很快水解酵素。可用蛋白酶的抑制劑防止之,但蛋白酶有數大類,各有不同類的抑制劑。一般使用 PMSF (phenylmethylsulfonyl fluoride) 是 Ser 型蛋白酶的抑制劑,但也抑制部分其它類型者,注意 PMSF 在水溶液中很快就會降解,每次使用都要重新補充。 (4) 酵素抑制劑: 在自然界中或以人工合成,發現許多酵素有抑制劑,可以專一性地抑制酵素活性;有可逆性的,也有不可逆的,通常不可逆抑制劑的效果都很強烈。 c. 如何保持活性: 若你的酵素不太穩定,活性不易保持,請參考下列處理方式: (1) 儘快進行純化及各項分析,隨時保持在 4℃ 或冰浴中。 (2) 讓酵素保存在硫酸銨固体沉澱中,要比溶液狀態安定得多。 (3) 勿讓高純度的酵素,保存在稀濃度溶液中,否則要加 BSA 當安定劑。 (4) 勿隨意凍結或解凍酵素液,可加防凍劑 (如甘油或醣類) 以液態保存。 (5) 冷凍乾燥雖可長期保存酵素,但有些酵素活性可能會因而下降。 (6) 若容易受微生物污染,可經無菌過濾後保存 (當然也會損失一些酵素)。 6.3.4 酵素活性單位: a. 活性單位 (activity unit, U) 是酵素活性高低的指標。一個活性單位的標準定義,是在固定溫及 pH 下,每分鐘可催化 1 mmole 基質的活性。但很多情況下,為了操作或計算的方便,直接用測定產物所得的吸光值,除以單位時間來表示活性,因此各種活性單位的定義可能不同,請特別注意。 b. 在提到酵素活性單位時,通常有兩種意思,一是指該酵素的總活性,單位就是 unit。另外,因為酵素本身大多為蛋白質,因此有蛋白質的質量 (mg),而 unit/mg 就是該酵素的 比活性 (specific activity)。比活性當然越高越好,表示在比較少量的蛋白質中,擁有比較多活性,比活性高者其酵素的純度也比較好。 c. 有關酵素活性及其基本背景,請複習生物化學中的酵素章節,你在大學所熟悉的基本酵素知識,在研究所或以後的任何階段,都還是完全適用。 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
問題集 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 酵素活性的測定,可觀察反應物消失或者生成物生成,何者較佳?請述明理由。 [2] 2. 活性分析時通常使用大量基質,要大到多少?(有一個公認的估計) 其目的何在? [3] 3. 在設計一個酵素活性分析方法時,應當注意那些要點,以免低估酵素活性? [3] 4. 酵素的催化條件受環境因子影響很大,而在試管中的反應與在細胞內的催化環境,一定有很大的差異,請儘你所知舉出兩者的差別,並說明其利弊。[3] 5. 酵素催化反應時若能把生成物除去,有何好處?如何以物理或化學方法去除之? [3] 6. 測定酵素活性為何要中止酵素反應?何種情況下可以不必中止反應? [3] 7. NAD+ 如何進行其輔酶的作用?請寫出其構造式。 [1] 8. NAD+ 為何能在 340 nm 波長的吸光有變化? [1] 9. NADH 與 NADPH 有何不同?能否互相通用? [2] 10. 340 nm 應當使用UV或者可視光的光源? [2] 11. 若生成物無法直接偵測,則要如何進行活性分析? [2] 12. 分析酵素活性時,雖然耦合反應與主反應一起連續著進行,但在反應動力學及實驗操作上,或者反應過程中基質及生成物的濃度上,二者有相當的差別,請檢討兩種反應的異同點。 [4] 13. 在酵素活性分析時,佐以耦合反應,有何好處?但有什麼可能的缺點? [3] 14. 請詳究澱粉磷解酶 (starch phosphorylase) 的催化反應,請列出所有可能的活性分析方法。 [2] 15. 何為還原醣?為何蔗糖不是還原糖,而葡萄糖及果糖則是? [1] 16. 請寫出轉化酶 (invertase) 的催化反應,並舉出可能的生成物偵測方法。 [2] 17. 請幫轉化酶設計一個使用放射線的活性分析方法。[3] 18. Phytochelatin synthase (PCS) 催化以下的反應,請幫忙設計活性分析方法: [3*] g-Glu-Cys-Gly + g-Glu-Cys-Gly → g-Glu-Cys-g-Glu-Cys-Gly + Gly 19. 有那些試劑或處理方式可以使蛋白質變性?其原理或機制各為何? [1] 20. 為何改變 pH 可以使得蛋白質沉澱下來?其變性的機制為何? [2] 21. 某化學小分子上有兩個官能基,其解離常數 pKa 分別為 4.5 及 11,請問這個小分子的等電點大約多少?這個小分子能否作為緩衝液?可以作為多少 pH 的緩衝分子? [2] 22. 請試著默寫 Henderson-Hasselbalch 平衡式,並以此平衡式解釋,為何弱酸或弱鹼具有緩衝環境 pH 的作用? [3] 23. EDTA 與 EGTA 有何不同?在使用上有何差異? [1] 24. 使用放射性試劑時,何謂 pulse-chase?在實驗上有何用途? [3] 25. 許多酵素在冰凍後受到傷害,活性因而下降,為此經常把酵素放在含有 50% 甘油的緩衝液中,凍藏在 -20℃ 中就不會結冰,可以直接取出來使用,非常方便。某生以此方式保存酵素,但每次取出來做活性分析時,分別取出 10 到 100 mL 体積,想要做一條校正直線 (酵素体積 vs 活性),但是無論嘗試幾次,這條直線的精準度都很差,檢測點大多無法落在直線上,請幫忙找出可能的原因,並且建議改善方法。 [4*] 26. 通常要進行活性分析的樣本都要稀釋,若某酵素的稀釋度為 1:10 時,測得 2 U/mL 的活性;當稀釋為 1:50 時,活性為 0.6 U/mL;稀釋 1:1000 時,活性為 0.05 U/mL。請問你應當如何判別所得數據?如何取捨?為何有這樣的情形? [5*] 27. 酵素的活性單位有一個公認的定義,請寫出如何定義 1 unit 活性單位。另外,活性單位也容許各自定義,且有其正當理由,請說明為何。 [3]
28. 酵素試劑通常都很貴,某生要購買酵素 X
做為實驗的標準品,發現廠商有多種形式如下,請問你如何幫他訂購最合適的種類?刮號內為美元報價。 [5]
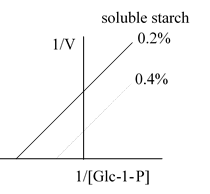
Type X-1: 1,000 units/1 gm (USD 10.00), Type X-2: 100 units/1 mg (USD 100.00) Type X-3: 1,000 units/10 gm (USD 5.00), Type X-4: 50 units/0.1 mg (USD 500.00) 29. 請由右圖澱粉磷解酶 L-SP 的酵素動力學實驗結果,推測兩種基質 (澱粉及 Glc-1-P) 與酵素之間的交互作用關係。 [5*] (也請解答 Pur 0 酵素實驗室問題集:7~15 題) [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ▲ |