|
酵素純化 Enzyme Purification 3 其他純化方法 Other Purification Methods |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
3.1 製備式電泳 3.2 超高速離心法 3.3 超微薄膜過濾法 |
簡單的實驗室製備式電泳 (酵素分析:電泳法) |
下載 [內文 pdf] [投影片 pdf] [影音檔 mp4] {BCbasic} 連結生物化學基礎
|
|
3 其他純化方法 |
參考資源 |
3.1 製備式電泳:製備式電泳通常以不含 SDS 的原態 disc-PAGE 進行,可回收具有活性的蛋白質;蛋白質樣本要先經部分純化,否則效果不佳,事先多以分析式電泳確定所要色帶的位置。詳細說明可參考酵素分析的電泳部分。 商品的製備式電泳器具很多,都相當複雜且昂貴,但使用一般 8 × 16 cm 大小的垂直平板電泳,再利用 3 mm 厚的間隔條即可進行,量小時用迷你電泳亦足夠使用。 (1) 鑄膠:分離膠体只佔全高度一半,焦集膠体佔四分之一,則樣本可佔其餘的四分之一 (以上述大小的膠体而言約有 15 mL),不必用樣本齒模,因此只跑一種樣本。 (2) 預跑:最好在樣本加入前,先預跑約 20 min,以除去 APS 的影響。 (3) 電泳:可在冷房進行,條件大略同一般電泳,勿使膠体過熱,也不要跑太快。 (4) 定位蛋白質:方法很多,蛋白質量多時可以 300 nm 波長紫外光照射直接觀察,切出所呈現的色帶;否則要先切一小條膠体染色,再比對位置切出色帶。 (5) 電泳溶離:以電泳收集膠体內的蛋白質,這一步會損失不少蛋白質,要特別小心。
|
|
|
|
|
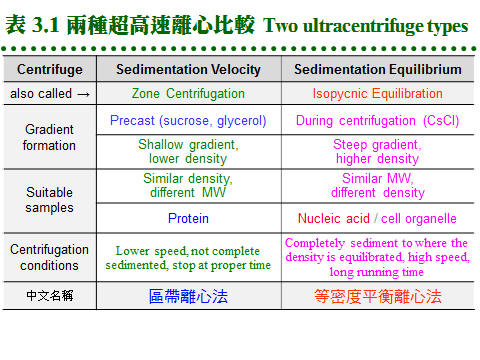
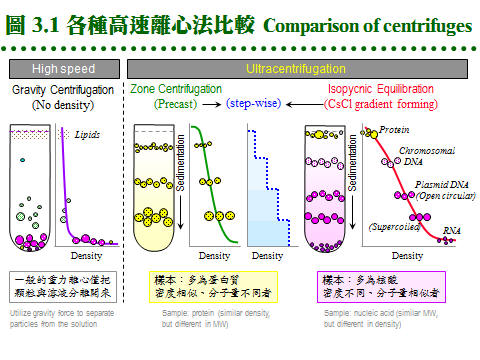
3.2 超高速離心法:蛋白質分子在離心時,其 分子量、分子密度、組成、形狀 等,均會影響其沉降速率,沉降係數 即用來描述此沉降性質,其單位為 S (Svedberg unit),每一種蛋白質的沉降係數與其分子密度或分子量成正比。不同沉降係數的蛋白質,可利用超高速離心法,在密度梯度中進行分離。 一般有三種製作梯度的方式: (1) 在樣本溶液中直接溶入 CsCl,經離心後可自動形成 CsCl 的濃度梯度。 (2) 使用梯度製造器,在離心管內預先拉好甘油或蔗糖的梯度,加樣本後離心。 (3) 若對蛋白質性質與離心條件極為熟悉,以上亦可以 階段式 (stepwise) 梯度進行。 上述 b (1) 及 (2) 二者,分屬兩類不同的離心形式,列表並以圖解說明如下︰ (每張圖表均連結有 960 x 720 清晰版本) 使用不同離心陀,有不同離心方式及效果。 (1) 角型 (angle rotor):典型的離心方式,多用在大量製備時,離心管與地面成一角度。 (2) 懸籃式 (swing bucket rotor):傳統用在密度梯度離心,離心管與地面平行。 (3) 垂直 (vertical rotor):取代懸籃式,離心管垂直地面,可大大縮短離心時間。 (4) 區帶 (zonal rotor):較特殊的離心陀,整個陀內分成幾個區帶,注入梯度與樣本。 (5) 連續式 (continuous rotor):可一邊離心,一邊加入或取出樣本,多為工業使用。 超高速離心因為轉速極高,離心陀構造也較複雜,操作上要非常小心,完全純熟後才能進行實驗,新手要有熟練者在旁指導。操作時特別注意下列各點: (1) 離心管的平衡要絕對準確,封管要確實,否則液体可能在真空中抽乾。 (2) 使用懸籃式離心陀,在懸掛離心管時,要注意有沒有掛妥,前後方向是否正確。 (3) 轉速切勿超過所使用離心陀的最高限,老舊離心陀的最高限還要打折。 (4) 離心後要清理離心陀,可用水沖乾淨後晾乾,尤其使用 CsCl 者非清洗不可。 (5) 時常檢查離心艙及離心陀,注意有無腐蝕及傷痕,有問題者立刻請廠商檢修。
|
|
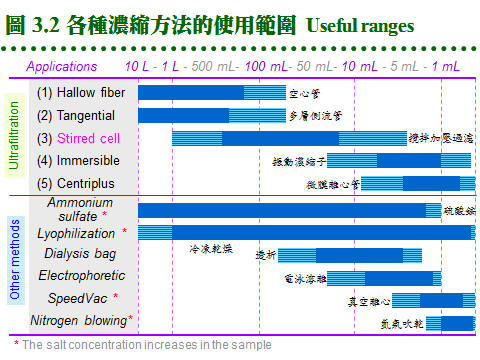
3.3 超微薄膜過濾法:離子交換法乃是利用分子帶電性質的差異來進行分離,解析力好且具多樣性,是常見且應用極廣的純化方法。 a. 超微薄膜過濾技術 (ultrafiltration, UF): (1) 使用具有極細孔徑的薄膜,可以分離分子量不同的分子。薄膜上細孔的大小固定,只能讓某分子量以下的分子通過,此分子量稱為該薄膜的 cut-off。 (2) 其基本原理類似透析,但 UF 薄膜的孔徑則更細,而且可選擇孔徑大小。應用這種薄膜技術的方式很多,主要用在 濃縮、脫鹽 及 無菌過濾。 (3) 另外在純水的製造上,以薄膜配合 逆滲透 (reverse osmosis, RO) 所製成的管柱,可除去水中 90% 以上的離子。 因樣本体積的大小不同,微膜有各種不同型態的設計,常用者如下: (1) 空心管 (hollow fiber):微膜薄層鋪在堅固空心小管的內側,當樣本通過空心管時,小分子則由側面擠出,比較不會有局部濃度太高的問題。 (2) 多層側流板 (tangential-flow):多層微膜疊在一起,樣本溶液的流動方向與微膜平面成平行,小分子由側向微膜擠出,也較無局部過濃的問題。 (3) 攪拌加壓過濾 (stirred cell):加壓迫使小分子擠過微膜,大分子留在原處,並在薄膜表面攪動,以防止局部過濃而阻塞微膜細孔。 (4) 振動濃縮子 (Immersible-CX):濃縮子直接浸入含有樣本的試管中進行,微膜平敷在濃縮子表面,並以振動方式去除局部過濃現象,沒有無效体積,故樣本損失量較低。 (5) 微膜離心管 (Centricon):離心管中央安置一微膜隔離,利用離心力把小分子擠過,大分子留在原處,樣本數目多而体積少時,多採用此法。 除了上述之超微薄膜系統之外,另有其他常用的濃縮方法︰硫酸銨沉澱、冷凍乾燥、透析袋濃縮、電泳溶離濃縮、真空冷凍離心、氮氣吹乾等。這些方法都很實用,但注意其中有部分在濃縮後溶液中的鹽濃度提高,可能會影響後續實驗,使用超微薄膜則無此缺點。圖 3.2 比較各種濃縮方法的適用体積範圍,一般實驗室常用的有:冷凍乾燥、stirred cell, Centricon (Centriprep) 及 SpeedVac。 |
|
問題集 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 進行製備式電泳時,明明只切出一條所要的色帶,為何再跑一次分析式電泳時 (SDS-PAGE),結果往往令人失望,經常出現其它色帶?有那些可能原因? [4*] 2. 進行超高速離心時,大分子的那些因素會影響其沉降速率? [1] 3. 為何 CsCl 可以在離心的過程中自動形成密度梯度?而蔗糖或甘油不能? [3] 4. 進行 zone centrifugation 時,若離心過久而不適時停止,則所有的蛋白質會不會全部沉降在離心管底部?為什麼? [4] 5. 垂直式離心是如何進行的?為何它能在短時間內達到分離效果? [5] 6. 超微薄膜過濾與傳統過濾法有何異同?操作時的最大問題是什麼? [4] 7. 以硫酸銨可以沉澱蛋白質下來,不但有蛋白質分劃效果,也可做為濃縮的步驟;但與冷凍乾燥及真空離心等濃縮方法,有何共同的問題,會影響下一步純化步驟? [3] 8. 某些情況下超微薄膜過濾的確對增進蛋白質的純度有所幫助,那是如何操作的? [4] 9. 有那些純化方法是利用蛋白質的等電點不同來分離的? [3] 10. 連續使用兩次相同的純化方法,經常無法得到有效的純化效果,請解釋原因。但在特殊情況下可連續用相同的方法,例如連續使用膠体過濾或離子交換法,請說明之。[4] 11. 某生在進行硫酸銨分劃,收集得蛋白質沉澱後,以最少量緩衝液溶之,得到 20 mL 粗抽取液。接著想進行膠体過濾,因管柱大小只能容納 10 mL 樣本,於是他用超微過濾法把樣本溶液濃縮成 10 mL 以進行下一步。請問他這樣做有無意義?會有什麼問題發生?若是你將如何處理? [4*] [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
| ▲ |