|
酵素純化 Enzyme Analysis 5 蛋白質定量 Protein Determination |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
5.1 Biuret Method 5.2 Lowry Method 5.3 UV Absorbance 5.4 Coomassie Blue Method 5.5 Other Methods |
以 CBG 定量蛋白質 |
下載 [內文 pdf] [投影片 pdf] [影音檔 mp4] [Protein] {BCbasic} 連結生物化學基礎
|
|
5 蛋白質定量 |
參考資源 |
|||||||
|
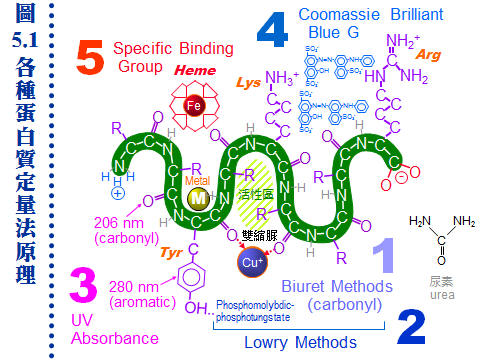
請注意以下三點酵素與蛋白質定量的基本問題: a. 蛋白質量與酵素活性不必定成正比: 酵素是一種蛋白質,因此測定純質酵素樣本中的蛋白質量,大致可說是該酵素的含量。但須注意酵素是具有活性的分子,蛋白質含量很高的,不見得活性就高。 b. 慎選標準品: 蛋白質定量需要一已知的標準品,以求得標準曲線,一般採用 白蛋白 (albumin) 或 免疫球蛋白 (immunoglobulin),使用不同的標準品所得到的結果,會有極大的差異。 c. 注意干擾因子: 樣本中的雜質或緩衝液都可能影響定量,因此檢測時濃度較高的樣本,所得結果可能會低估,而稀釋倍數較大的樣本,因所含干擾物質被稀釋,測定值比較可靠。 5.1 Biuret 法:銅離子在鹼性溶液中,可與蛋白質胜鏈上的 carbonyl 基結合,生成紫色複合物,兩個 carbonyl 與一個銅離子結合成類似 雙縮脲 (biuret) 複合体,因此若蛋白質濃度越濃,其呈色就越高。然而其 精確度 較差 (數 mg),且受到樣本中硫酸銨及 Tris 干擾,但 準確度 較高且不受蛋白質的種類或成分之影響。後來由 biuret 法發展出更靈敏的 BCA 呈色法,利用兩分子 bicinchoninic acid 與結合在蛋白質上的銅離子反應,進一步的呈色使精確度大大提升。 5.2 Lowry 法:也是上述 biuret 呈色法的延伸,當銅離子與胜鏈形成複合物後,可再與 Folin-Ciocalteau 試劑的 phosphomolybdic-phosphotungstate 作用產生藍色物質,蛋白質中的芳香族胺基酸也會與 Folin-Ciocalteau 試劑結合呈色,因此比 Biuret 更靈敏 (約 0.1 mg) 但反應步驟較多,也受到硫酸銨及硫醇化合物的干擾。步驟中各項試劑的混合,要特別注意均勻澈底,否則可能有大誤差。 5.3 UV 吸光法:a. 芳香基團: 胺基酸的芳香基團在 280 nm 有吸光,蛋白質胜鏈骨架上的 carbonyl 基團在 206 nm 附近有吸光,蛋白質濃度越濃則吸光度就高。由於各種蛋白質所含芳香族胺基酸組成不一,在 280 nm 的吸光能力亦不同,可以 分子消光係數 (molar extinction coefficient) 表示。 b. 分子消光係數: 一般以 E (1%, 280 nm) 來表示,大部分蛋白質在 4~15 間 (平均為 10)。若某蛋白質 E 值為 10,其溶液在 280 nm 吸光值為 1,則此蛋白質的濃度為 1 mg/mL。可以下式計算︰ 吸光值 = E × b × c (c 為蛋白質 % 濃度,即每 100 mL 所含蛋白質的克數;b 為光徑 1 cm) c. 略估蛋白質濃度: 此法只有在蛋白質純度很高時,才能精確測定,但若將普通蛋白質的 E 值平均定為 10,則對粗抽取液的略估相當方便:在 280 nm 的吸光值為 1 時,濃度約為 1 mg/mL。 5.4 Coomassie Blue (dye binding) 法:Bradford MethodCoomassie Brilliant Blue G-250 (CBG) 在過氯酸溶液中呈紅棕色,但與蛋白質結合後則變成藍色,呈色可測 595 nm 波長的吸光。此法方便靈敏 (達 0.01 mg),且可使用微量滴定盤進行分析,降低試劑用量,方便大量樣本的操作。請注意電泳膠片染色所用的 Coomassie Brilliant Blue 是同系列的另一種 R 產物 (CBR),顏色稍偏紅,與 CBG 用途不同。 5.5 其它方法:有些蛋白質含有特殊的 非蛋白質基團,如 peroxidase 含有 heme 基團,可測 403 nm 波長的吸光來定量之。含有特殊金屬的酵素 (如鎘),則可追蹤該金屬。 (本圖連結有 960 x 720 清晰版本) 圖 5.1 說明各種蛋白質定量方法所根據的原理,目標蛋白質在中央以捲繞的綠色粗線表示,其上並標出蛋白質的脊骨 (-N-C-C-N-C-C-),胺基酸上的幾種官能基團 (Lys, Arg, Tyr等),都可被用來作為定量的根據。 |
|
|||||||
問題集 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 請寫出下面一小段胜肽的分子構造,請指出所含有的特殊化學基團,並以此說明對其立體構形所造成的影響。 [5] Glu-Cys-Ala-Trp-Lys-Phe-Cys-Asn-Leu-Tyr-Tyr-Gly 2. 請查出各種蛋白質定量方法,並做表註明以下各項特徵或性質:[1] 定量反應的原理、靈敏度範圍、專一性、所測的波長、反應所受的干擾、優缺點 3. 某蛋白質的 206 nm E1 mg/mL = 31,當測得 206 nm 的吸光為 1.0 時,此蛋白質濃度多少? [3] 4. 某蛋白質 X 的分子量為 10 kD,已知其分子消光係數 (280 nm E1 mM) 為 20,若你測得該蛋白質溶液在 280 nm 的吸光值為 1,則此溶液的蛋白質濃度應為若干 mg/mL? [4] 5. 以 UV 吸光度定量蛋白質時,樣本的純度要很高才有意義;但另一方面來說,對於一個粗抽取液的蛋白質樣本,也可以用吸光度來測定其濃度,且通常不會偏差太多,請討論其意義如何? [3*] 6. 請詳細說明 Coomassie Brilliant Blue 蛋白質定量的呈色原理。 [1] 7. Biuret 反應的原理如何?為何稱為 Biuret reaction? [1] 8. 某蛋白質並無方便的活性或定量方法,但其分子含有鎘,可如何追蹤此蛋白質? [2] 9. UV 280 nm 與 206 nm 都可用來定量蛋白質,但其所根據機理不同,請說明其優劣點。[2] 10. 那幾種蛋白質定量法最準確,不會受到所含胺基酸組成的不同所影響? [2] 11. 常用的 Coomassie Brilliant Blue 蛋白質定量法要以標準蛋白質做比對,定量結果會因所用標準品不同而有偏差,請問為何?如何避免之? [3*] 12. 某非極性蛋白質需要界面活性劑 (0.1% Triton X-100) 做為溶入劑,因此所有的緩衝液都含有 Triton。在進行 Coomassie Brilliant Blue 定量蛋白質時,發現不管樣本中有無蛋白質,都呈現很高的呈色反應,請問是發生了何種問題?如何改善之? [2*] [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
|||||||
| ▲ |