|
酵素純化 Enzyme Analysis 7 電泳檢定法 Electrophoresis |
總目錄 ■ 上課網 ■ 下載區 ■ |
||
|
參考資源 |
|||
|
目 錄 |
7.1 電泳原理 7.2 聚丙烯醯胺膠体電泳 7.3 其他相關技術 |
下載 [內文 pdf] [投影片 pdf] {BCbasic} 連結生物化學基礎
|
|
|
影響泳動率的重要因素 |
|||
|
7 電泳檢定法 |
參考資源 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
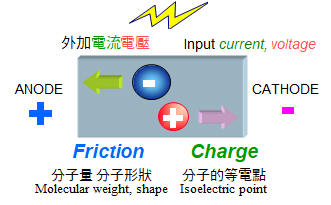
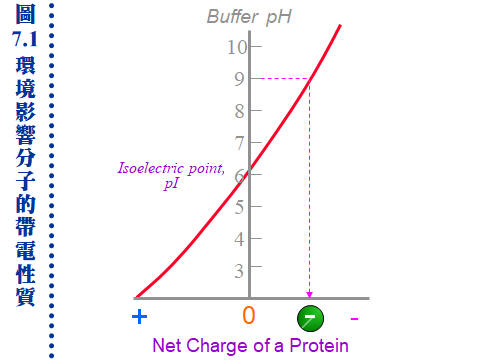
7.1 電泳原理:7.1.1 蛋白質的泳動率: a. 泳動率: 帶電分子在電場中會被電流緩慢移動,是為 泳動,其泳動程度的大小稱為 泳動率 (mobility)。泳動率與分子上 電荷密度 成正比,而與其分子的 摩擦力 成反比:
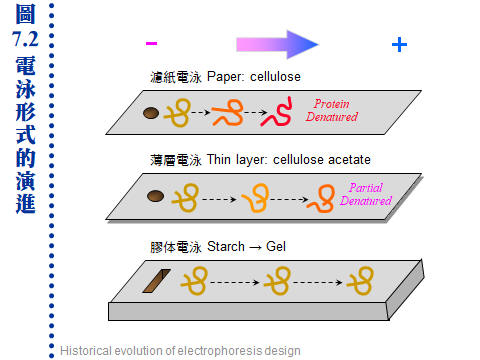
上述之摩擦力,決定於此分子之 大小、形狀。分子量大者摩擦力大,泳動率小;而球形分子摩擦力較小,泳動率大。 b. 蛋白質的帶電性: 蛋白質分子所帶的淨電荷,取決於環境 pH 的高低。若環境 pH 高於其 pI,此蛋白質帶淨負電,反之帶正電;若剛好等於 pI,則淨電荷為零 (正電數目等於負電)。因此同一分子在不同 pH 環境下,可能帶有不同 淨電荷 (圖 7.1)。 (每張圖均連結有 960 x 720 清晰版本) c. 蛋白質大多由負極向正極泳動: 在電泳系統中電子由負極流向正極,因此帶負電的分子會跑向正極,帶正電的分子往負極跑,不帶電者則不易泳動。大部分電泳系統的 pH 定在 8.3,因為大多數蛋白質的 pI 都小於 8.3,因此都帶負電往正極跑,但若蛋白質 pI = 8.3 就跑不動。 d. 條件影響泳動率的外在因素: 促進泳動:低膠体濃度 (孔徑大)、低濃度緩衝液、高電壓、高電流、高溫。 降低泳動:上述各點的相反條件、樣本含高濃度鹽類、樣本 pH 太高或太低。 7.1.2 電泳種類: 電泳需有一介質,作為電泳之場所 (圖7.2)。最早是在溶液中進行,但因溶液的擴散現象大,故改用噴濕的濾紙。後來又因為濾紙與分子間的吸引力大,導致摩擦力太大而發熱嚴重,故現今都用半固態的膠体。 a. 全液相電泳 (moving-boundary electrophoresis)︰ 如上述已甚少使用,但有些特殊的大量製備式裝置仍使用類似原理。 b. 帶狀電泳 (zone electrophoresis): 使用固相或膠体的電泳介質,蛋白質樣本電泳後,在介質上呈現帶狀 (band 或稱色帶),故稱之。 (1) 濾紙電泳: 濾紙纖維素的吸附性大,蛋白質很容易變性失活,因此多用在小分子樣本 (如胺基酸) 或雙向胜肽電泳 (蛋白質先經水解成胜肽片段),可得其胜肽圖譜。 (2) 薄層電泳: 以化學方法修飾纖維素的醇基 (乙酸化) 成為粉末狀 cellulose acetate,再製成懸濁乳液塗佈在玻璃片上,形成一薄層以進行電泳,可降低對蛋白質的吸附。 (3) 膠体電泳: 組成膠体的分子長鏈間,有相當大的空間讓蛋白質泳動,並降低與蛋白質間的摩擦力,且可增大樣本体積,適用於巨分子,如核酸及蛋白質。有以下三種方式: 澱粉膠体電泳 (starch gel electrophoresis) 聚丙烯醯胺電泳 (polyacrylamide gel electrophoresis, PAGE) 洋菜糖膠体電泳 (agarose gel electrophoresis) c. 其它電泳技術: 以下技術大多會在其他各章節中說明 (1) 等電焦集法 (isoelectric focusing):根據蛋白質的等電點不同來做分離。 (2) 胜肽圖譜 (peptide mapping):不同的蛋白質有不同的胜肽圖譜。 (3) 蛋白質轉印 (Western blotting) → 免疫染色 (immunostainning) (4) 製備式電泳 (preparative electrophoresis):可以純化高純度蛋白質。 (5) 免疫電泳 (immunoelectrophoresis):電泳後再以抗体與抗原反應,可產生沉澱線,也是有兩個次元 (電泳、雙向免疫擴散)。 (6) 毛細管電泳 (capillary electrophoresis):最新的電泳儀器,有點像 HPLC。 (7) 脈衝場電泳 (Pulse field gel electrophoresis):可做大分子 DNA 甚或整條染色体之分離。 7.1.3 電泳設備及系統選擇: a. 電源供應器:大約 100~500V 者即可適用,但等電焦集法則需數千伏特。 b. 電泳槽:垂直或水平、柱狀或平板、普通 (16 × 20) 或最常用的 迷你型 (8 × 10)。 c. 系統選擇: 上面各種電泳方式,各有其適用對象,請見表 7.1 的分類。 表 7.1 各種電泳形式的選擇與用途:
|
[電 泳] [History]
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
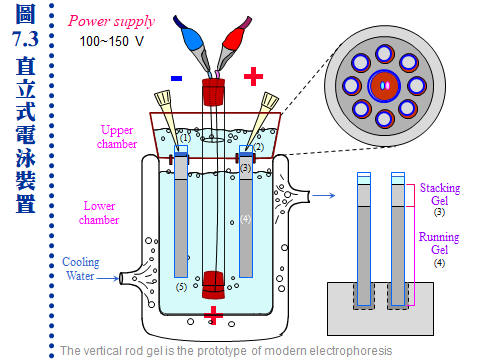
7.2 聚丙烯醯胺膠体電泳:聚丙烯醯胺膠体電泳 PAGE 是最普遍的蛋白質電泳方式,以下各段分別說明 PAGE 的種類、構成與電泳原理,以及實驗操作可能遇到的問題與解決方法。 7.2.1 PAGE 種類: a. 原態膠体電泳 (disc-PAGE) 及活性分析: Disc-PAGE 是 PAGE 系列的最基本型式,蛋白質以原態進行電泳,因此酵素活性在電泳後得以保留,可繼續在膠片上直接做活性測定或染色。若能收集到膠体上的蛋白質,則亦可用來製備酵素。因為樣本蛋白質保持在原態下,所帶的電荷、分子大小、分子形狀等,對其泳動率均有影響,與下述 SDS-PAGE 不同。 b. SDS 膠体電泳 (SDS-PAGE) 及分子量測定: SDS 是界面活性劑,可使蛋白質變性,並在分子表面均勻塗佈上一層負電荷,因此在 SDS-PAGE 系統中,樣本分子的泳動率,僅取決於其分子量,而與原來分子所帶的電荷無關,故 SDS-PAGE 可用來測定變性狀態下 (denatured) 蛋白質之分子量,與原態 (native) 分子量可能不一樣。 c. 梯度電泳系統: 垂直梯度電泳使用由稀到濃的漸進膠体,膠体中的孔徑由上到下逐漸變小,樣本中分子量越小的分子,就可跑得越下面,因此它可說是依分子量大小來分離的。但需注意許多 pI 大於 8.3 的蛋白質,在電泳 pH 條件下所帶的淨電荷為正,在膠体中根本不會泳動。梯度電泳也可加入 SDS,成為 梯度-SDS-PAGE,則解析度將會大大的增強,是最理想的電泳型式。但梯度的操作步驟相當繁複,因此很少在實驗室中進行。 7.2.2 PAGE 膠体組成: 7.2.2.1 膠体主要成分:以下這些成份共同組成了膠体 a. 單体分子 (monomer):丙烯醯胺 (acrylamide),H2C=CH-CO-NH2。 Acrylamide 及下面的 Bis 都有神經毒性,操作要帶手套,並避免吸入塵埃。 b. 架橋分子 (bridge):Bis [N,N'-methylene-bis(acrylamide)] 可看成兩個丙烯醯胺單体分子連結在一起,凝膠時可形成分叉點,以變構成膠体的立体結構。 c. 游基 (free radical) 產生者:通常使用 過硫酸銨 (ammonium persulfate, APS) 或者 riboflavin (即 維生素 B2),注意 APS 很容易失效。 d. 催化劑:TEMED (tetramethylethylenediamine) 幫助上述游基電子之傳遞。 7.2.2.2 鑄膠反應:有三種基本反應 a. 游基形成:靠上述 游基產生者 生成游基,再使單体分子成為游基型式。 b. 聚合反應:成為游基的單体再首尾相接,以連鎖反應形成大分子的長鏈。 c. 交錯連結:若架橋分子加入上述聚合反應,則可分叉形成網狀三次元結構。 7.2.3 PAGE 系統解剖: 7.2.3.1 電泳系統的組成:PAGE 膠体的組成有點複雜,而且不是連續或均質,有其重要功能。 表 7.2 電泳膠体系統的組成部份:
a. 只有 3, 4 兩部分是膠体,各層的緩衝液成份不盡相同,其 pH 也有點差異。注意膠集膠体 (3) 的 pH 較低 (pH 6.9, 是 glycine 的 pI)。這些差異造成很重要的效果,使得樣本在通過焦集膠体時,可產生 焦集作用,使原來体積很大的樣本溶液,聚集成一薄層 (disc),可增加解析度。 b. 以直立式柱狀電泳為例,電泳膠柱如圖 7.3 的組成,玻璃管內的下方為分離膠体 (4),其上則為焦集膠体 (3)。焦集膠体上方的空間 (2),可供灌注樣本溶液。膠柱上下兩端,分別接兩極的緩衝液槽 (1) 及 (5),以連結電源 (注意正負方向)。 c. 除了上述的柱狀電泳外,目前大多使用平板式電泳,可分為直立式或水平式。應用在蛋白質時,以直立平板式的聚丙烯醯胺膠体為最多。若用在核酸,則以水平平板式洋菜醣膠体較普遍。
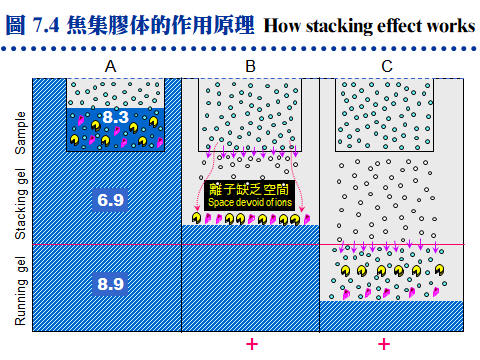
7.2.3.2 電泳的焦集作用:
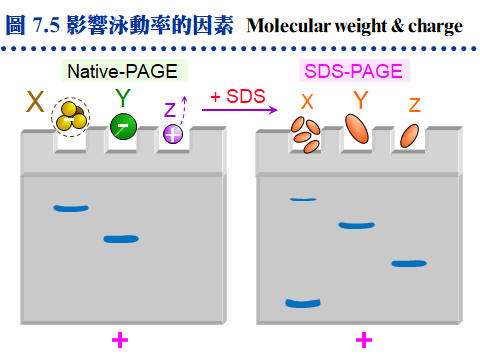
請注意下面三種分子 (如右),在電泳的表現: Glycine:圖中以黑點 (當環境 pH > 6.9 時,帶負電) 或白點 (當環境 pH = 6.9 時,為不帶電之 zwitterion) 表示。 氯離子:以斜線部分表示。 樣本分子:以兩種大小蛋白質為例。 a. 圖 7.4A:上述組成電泳的五個部分中,只有膠体的緩衝液含氯離子,而樣本溶液中則含有 Gly,沒有氯離子。 b. 注意 樣本溶液-焦集膠体-分離膠体 三段 pH 是不連續性的,其 pH 分別為 8.3-6.9-8.9,而 Gly 的 pI 恰為 6.9。 c. 圖 7.4B:電泳一開始 Gly 進入焦集膠体,立刻變成不帶電的的分子 (白點),泳動率變小,同時氯離子則很快往正極泳動,因此在氯離子與 Gly 之間有一段缺乏離子的空間,電壓變得很高。 d. 然而兩電極之間,要有負離子來帶動電流,此時只得利用蛋白質來傳導。而焦集膠体中的孔隙較疏,於是樣本蛋白質不論分子大小,在此離子缺乏空間,全部快速往正極泳動,一直碰到氯離子的尾端而聚集成一薄層,產生濃縮效果。 e. 圖 7.4C:Gly 還是可以慢慢通過焦集膠体,變回負離子,離子缺乏帶瓦解,蛋白質泳動到分離膠体後,開始依其分子量、電荷等因素泳動。 7.2.3.3 兩種電泳系統比較: 表 7.3 及圖 7.5 以三個虛構的蛋白質為樣本,說明 disc-PAGE 及 SDS-PAGE 兩種電泳性質上的異同,以及電泳結果的差別 (也可參考問題集第 32 題)。 表 7.3 三個假設蛋白質的性質比較:
a. 假設有三個蛋白質 X, Y, Z,原態分子量大小依次為 X > Y > Z,在一般電泳的 pH (8.3) 條件下,X 及 Y 的淨電荷為負 (pI < 8.3),而 Z 的淨電荷為正 (pI > 8.3)。 b. 在 native-PAGE 只有 X, Y 會往正極跑,而 Z 卻往負極跑,在膠体中就看不到 Z。而 X 的原態分子量最大 (160 kD),因此跑得比 Y 慢。(圖 7.5 左側膠片) c. 在 SDS-PAGE 系統中 X, Y, Z 先以 SDS 處理過,表面均勻地敷上一層 SDS 負電 (有相同電荷密度),則原先的分子電荷完全被蓋掉。(圖 7.5 右側膠片) d. 在 SDS 膠体中進行電泳時,由於 X, Y, Z 分子表面均帶負電,所以都往正極跑。又因三者的電荷密度一樣,影響其泳動率的因素,只剩下了分子量一個因素,造成分子量小的泳動率較大,而分子量大的泳動率較小,因此 Z 跑得比Y快。 e. 分子 X 的原態分子量大於 Y 或 Z,但其分子為四元体,而在 SDS-PAGE 中,此四元体會被 SDS 分解成為單元体,其單元体分子量 (40 kD) 小於 Y 或 Z,反而表現出最快的泳動率。 f. 在 SDS-PAGE 系統中,若 SDS 的處理條件較緩和,或樣本蛋白質較不易變性者,在電泳結果上,有可能會出現原態分子量的 X 四元体 (160 kD)。 7.2.4 結果不佳時: a. 膠体不凝結: 檢查 ammonium persulfate, TEMED, acrylamide 等試劑品質是否良好,或是 APS 濃度太稀。室溫太低亦不易凝結,要稍微加高 APS 濃度。 b. 膠体凝結不良: 當膠体成為半固体粘液狀時,檢查膠体溶液的百分比對否?是否忘了加 Bis?所用的 acrylamide 品質是否良好? c. 下雨: 染色後若有許多垂直細線 (下雨),可能是膠片中有小氣泡,或是樣本中有不溶物質,或所用樣本溶液中的 b-mercaptoethanol 品質不佳。若 acrylamide 溶液變質,產生固体微粒,也可能出現下雨現象。 d. 色帶扭曲: 染出的色帶形狀扭曲 (如波浪狀),可能是蛋白質溶解度不好,或樣本中含太高的鹽類。凝膠不均勻時,也會有色帶扭曲的現象,可能是 APS 沒有溶解完全。 e. 樣本干擾物質: 色帶擴散太過,有嚴重拖尾現象或左右拉寬,可能是樣本液的 pH 不對 (一般是過酸),或者樣本中的鹽濃度太高。 f. 溫度不均: 膠片左右兩邊泳動的速度不一時,請檢查跑得慢的那個方向,有無冷氣或風扇吹來,降低那一邊膠片的溫度。 g. 無焦集作用: 色帶太粗,似無焦集作用,檢查焦集膠体溶液的 pH 是否確實為 6.9。 h. 清理樣本槽: 有時電泳膠片的結果看起來就是不好,但找不出主因,請試著在注入樣本前,特別在每個樣本槽內,用微量針筒灌入緩衝液洗過數次 (像刷牙一樣),因為樣本槽內可能殘留著凝膠後的化學物質,若沒有洗淨就可能造成原因不明的膠片缺陷。 |
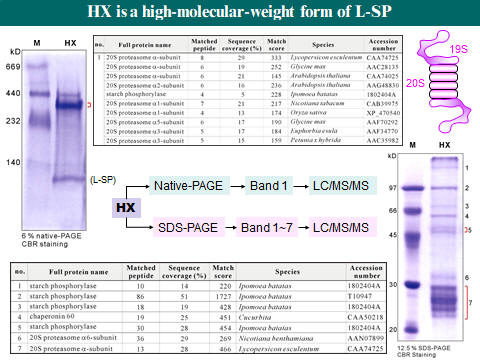
[PAGE]
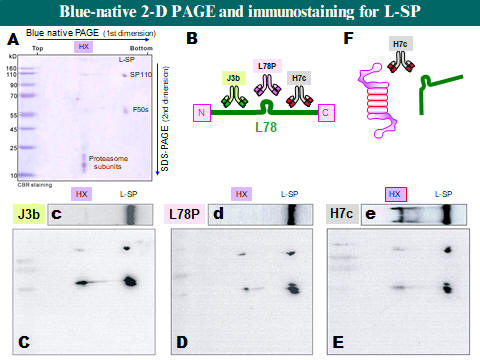
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
[結果不佳膠片]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
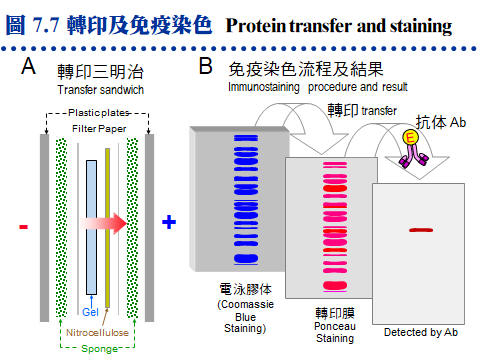
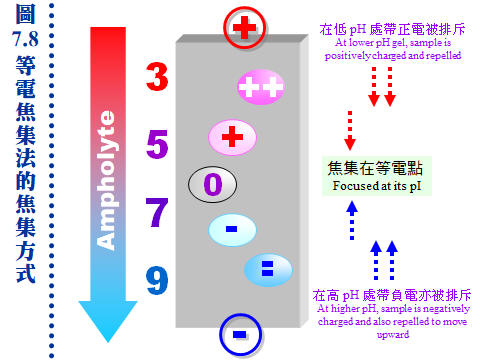
7.3 其他相關技術:7.3.1 染色及乾燥: 膠片在電泳後要進行染色,才能看到樣本蛋白質所呈現的色帶。圖 7.6 說明數種常用的蛋白質染色法機制 (圖中數字連結本文中各染色法)。 a. 一般染色法: (1) 硝酸銀 (ammoniacal silver) 染色: 以銀氨錯離子形式與蛋白質結合,銀離子再還原成金屬銀的深褐色。其靈敏度比下述 CBR 染色法高十至百倍,但步驟較繁複。 (2) Coomassie Brilliant Blue R-250 (CBR) 染色: 最常用的染色法,快速而方便,靈敏度中等。利用 CBR 上的芳香基團與蛋白質的非極性區結合,以及所帶負電與蛋白質的正電基團結合。注意染色用的 Coomassie Brilliant Blue 為 R-250,不要誤用 G-250,後者用在蛋白質定量。 b. 醣蛋白: 醣蛋白 (glycoprotein) 上糖類分子的相鄰醇基 (diol),可用過碘酸氧化成醛基後,再加入 (3) PAS (periodic acid-Schiff's) 試劑染成紅色,靈敏度比 CBR 低,請步驟很繁複。前述的醛基也可改用硝酸銀染色,後段的步驟稍有不同,靈敏度比 Schiff 試劑高。 c. 紫外線照射: 製備式電泳後,可用 UV 300 nm 照射之 (4),蛋白質會呈現暗紫色色帶,但不靈敏。 d. KCl 沈澱法: SDS-PAGE 中濃度較高的色帶可以用 0.3 M KCl 在 4℃ 下浸泡 15 min (5),蛋白質會呈現白色混濁,因為 SDS 遇鉀形成 KDS 溶解度下降之故,靈敏度也不佳。 e. 活性染色法: 若酵素反應會產生不溶性的有色物質,則可進行 活性染色 (6),但多數酵素須以原態 PAGE 膠片進行。可惜大部分的酵素,均無法產生有色的生成物,則可把膠片分劃,橫切成單位小片 (disk),每小片放入試管,再以一般的活性測定法,在試管中加入基質液,分析每小片所含的酵素活性。這種固相酵素的反應,可以拉長反應時間,以提高生成物濃度,方便偵測到活性。 f. 放射顯像法 (autoradiography): 可檢測樣本中的放射性物質,但要以 X 光片壓片顯影。 g. 膠片乾燥法: 大部分的膠片均可利用 玻璃紙三明治法 進行乾燥,效果相當良好,商品的膠片乾燥機 (gel dryer) 不是必要的設備。乾燥後的膠片,經過熱膠膜護貝後,可以長期保存。 7.3.2 蛋白質轉印法: a. 電泳後若要對膠体上的蛋白質色帶進一步檢定,則先轉印到 硝化纖維 (nitrocellulose) 紙 (圖 7.7A 轉印三明治),因為膠片無法直接進行操作。近年來多以 尼龍 (nylon) 取代硝化纖維紙,質地較韌、背景呈色也較低。 b. 轉印到硝化纖維紙上的蛋白質,可先用 ponceau 或 amido black 染成紅色或黑色,再以 免疫染色法 (immunostaining) 專一性地染出目標分子 (圖 7.7B)。 c. 轉印以後的蛋白質色帶,在定位後可以剪切出來,直接進行其胺基酸定序。 7.3.3 等電焦集法 (IEF): Ampholyte 是一種化學物質混合物,含有各種連續 pI 的小分子。若在聚丙烯醯胺膠体內加入 ampholyte,通電後 ampholyte 會在膠体中形成連續 pH 梯度,當樣本中的蛋白質泳動至相等於其 pI 的 pH 位置時,其淨電荷變為零 (pH = pI),因而焦集於該處不動 (圖 7.8)。因此 IEF 是依樣本分子 pI 的不同來進行分離,其解析力非常好。 7.3.4 二次元電泳: 第一次元先在垂直式的柱狀膠体上做 IEF,跑完後取出膠柱,水平放到平板式 DS-PAGE 的膠片上方,再進行第二次元的電泳 (圖 7.9)。二次元電泳可分析複雜的樣本,如細胞內的全部蛋白質或胜肽圖譜,亦可轉印到硝化纖維紙後,再以抗体做免疫染色。第一次元也有人用 disc-PAGE,有其特殊分離效果,也比較方便 (參考問題集第 33 題)。近年來,因為蛋白質体學 (proteomics) 的蓬勃發展,二次元電泳成為分析蛋白質体的重要工具,用來比對複雜蛋白質体之間的變化情形。
|
[Staining]
[CBR]
[IEF]
[2-DE]
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
問題集 (每個問題不一定都有標準答案,甚至會引起很大的爭議,但這就是問題集之主要目的)1. 那些外在因素影響蛋白質在膠体電泳中的泳動率? [1] 2. 正負電極槽的緩衝液有一定使用濃度,某生不小心錯泡為十分之一濃度,會有什麼結果發生? [3] 3. 電泳時溫度過高時,對電泳結果會有什麼影響? [2] 4. 請詳述整個 PAGE 電泳膠体的鑄膠過程,及其凝膠機制。 [1] 5. PAGE 中有一層焦集膠体,它是如何把樣本蛋白質焦集成一細線的? [2] 6. 相差一個核苷酸的兩段短核酸 DNA,有無可能用電泳分離開來? [3] 7. 為何樣本中含有太高鹽類,或 pH 太低,均會影響電泳結果? [2] 8. 為何蛋白質不適合使用濾紙或 TLC 作為電泳介質? [2] 9. 原態電泳 (disc-PAGE) 中,是否所有的蛋白質樣本都會往正極跑泳動? [1] 10. Disc-PAGE 比起 SDS-PAGE 有何優點?又有何缺點? [2] 11. 以 SDS-PAGE 分析一具有四元体的蛋白質酵素,有無可能看到該四元体的色帶? [3] 12. Disc-PAGE 以梯度鑄膠,可以用來分析蛋白質的原態分子量,但請問有何限制? [4] 13. SDS-PAGE 的樣本要用 SDS, b-mercaptoethanol 及加熱處理,各有何作用? [2] 14. 以 SDS-PAGE 可以測得蛋白質的分子量,就蛋白質本身的胺基酸組成而言,有那些因素會影響所測得分子量的準確性? [3] 15. 若你要分析的異構酶群族具有很廣汎的 pI,例如由 4 到 11 都有,則使用 disc-PAGE 能不能看到所有的異構酶?你應當進行何種電泳才能看到所有的異構酶? [4] 16. 進行電泳時,固定電壓、電流或電功,分別對電泳過程或結果有何影響? [4] 17. 洋菜多在為水平式電泳,PAGE 多用在垂直式,為什麼? [4*] 18. Acrylamide 常有不溶性的雜質,需以過濾去除,否則電泳結果會有何種問題? [2] 19. 樣本中各種成份對電泳結果影響很大,請問下列物質或處理對電泳的影響為何? [4] (a) 0.5 M NaCl, (b) 0.05 M KCl, (c) 樣本 pH = 3.0, (d) 樣本蛋白質 = 10 mg/mL 20. 請說明各種呈色方法的原理:Coomassie Blue, Silver staining, PAS staining。 [1] 21. 有那些方法可以在膠片中染上蛋白質色帶的碳水化合物?原理如何? [1] 22. 在膠体電泳後直接進行活性染色是最方便而專一性高的方法,但並非所有的酵素都可以在膠片上進行活性染色,請列出所需要的條件與限制。 [4 ] 23. b-澱粉酶可以 Coomassie Blue 染色,但硝酸銀反而不能染上色,請試解釋之。 [1] 24. 硝酸銀染色完成後,可洗掉銀粒子再重新染色,要如何去掉色帶上的金屬銀? [4] 25. 電泳後某生以 Coomassie Blue 染色脫色後發現,色帶全都分裂成水平平行的兩條色帶,好像每個色帶都有個影子。請問為何?(他用的是垂直平板式 disc-PAGE,使用 1.5 mm 厚的膠片,染色 15 min) [4*] 26. Ampholyte是何種物質?有何用途?作用機制為何? [2] 27. 電泳後可把蛋白質轉印到硝化纖維紙,然後有何用途?非得轉印到紙上不可嗎? [1] 28. 蛋白質經酵素水解後,如何檢定其胜肽片段?有那些方法可以分離這些片段? [2] 29. 某蛋白質經純化至均質後,以 IEF 檢視其 pI,發現此蛋白質在其預測的 pI 附近拖拉成一片無法焦集,且似有固体產生。請問發生了什麼問題?有無改善的可能? [4*] 30. 那一種蛋白質在進行 SDS-PAGE 時,無法表現出正常的泳動率? [3] 31. 澱粉磷解酶 L-SP 的原態分子量為 220 kD (110 kD × 2),但是在純化過程中,經常發現有一種分子量超大的 L-SP 形式,稱之為 HX。把 HX 分別進行原態的 disc-PAGE 及變性的 SDS-PAGE,再分別收集色帶進行質譜儀分析,得到如下圖表的結果,你可以推得 HX 的組成嗎? [4*] 32. 把上一題的 HX 收集下來,用一種特殊的二次元電泳進行分析,其整個過程與結果如下圖,請依照字母順序逐一瞭解並回答問題: [5*] (A) 有別於一般二次元電泳,第一次元改用原態 disc-PAGE,但第二次元仍為 SDS-PAGE,然後用 CBR 染色,可以看到 L-SP 被分成了原來單体長度的 SP110 及其降解產物 F50s,也可以看到 proteasome 的各個單体,HX 則標出其泳動位置。 (B) 若把 L-SP 的分子分成 N 端、C 端及中央的一段 L78 片段,並且各自取得其專一性單株抗体,分別是 J3b, L78P 及 H7c 三種抗体。然後再分別對上述 (A) 的二次元電泳轉印進行免疫染色,得到 C, D, E 三張二次元染色圖譜。另外,三種抗体也對一次元原態電泳進行轉印染色,得到如 c, d, e 三張一次元染色圖譜。 (C) 從 J3b 抗体染出來的二次元圖譜,可以看到 SP110 及 F50s,也可以在 HX 的位置看到被 SDS 解開的 SP110 及 F50s。然而有趣的是,在一次元的原態條件下,J3b 幾乎染不到 HX (c),而 L-SP 則是正常染色。 (D) L78P 抗体與 J3b 一樣,也不能在原態電泳上染到 HX (d),但卻可以染到 SDS 下的兩種 L-SP 形式 (D)。 (E) H7c 抗体則與其他兩種抗体不同,可以很清楚地染出 HX (e)。 (F) 已知 HX 中含有 L-SP 及 proteasome,而 H7c 可以與 L-SP 結合,請推測一個三者之間的蛋白質交互作用機制,並解釋所得到的實驗結果。 [題目後面方括號內的數字代表該題的難易程度,3 為中等而 5 最難回答,標有 * 為實際問題] |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ▲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||