|
生物化學基礎 Biochemistry Basics 2008 蛋白質 Protein |
回首頁 ■ |
||
|
|
|||
|
目 錄 |
1 蛋白質構造 1.1 一級構造 1.2 二級構造 1.2.1 二級構造相當規律 1.2.2 連結性二級構造 1.3 三級構造 1.3.1 三級構造的組成力量 1.3.2 三級構造的立體構成 1.3.3 三級構造的修飾 1.4 四級構造 2 蛋白質性質 2.1 變性及復性 2.2 蛋白質構形是活動的 2.3 蛋白質的專一性結合 3 蛋白質研究技術 3.1 蛋白質純化技術 3.2 蛋白質性質與構造檢定 3.3 胺基酸序列決定法 3.3.1 傳統胺基酸定序法 3.3.2 cDNA定序 3.3.3 以質譜儀定序 |
蛋白質的構形是所有生命機能的根本 |
|
|
■ 蛋白質 |
■ 相關投影片 |
|
蛋白質具有各種催化及生理機能,是細胞的主要工作機器,其功能源自蛋白質分子所具有的特定構形,及因此所產生的催化活性。此種構形的形成,又因於組成蛋白質的胺基酸排列次序。 各種大小的蛋白質有不同的胺基酸組成與排列,造就了多樣而多功的蛋白質繽紛世界。 ◆ 胺基酸與蛋白質的故事 (以漫畫說明胺基酸如何組成蛋白質) |
|
1 蛋白質構造:探究蛋白質構造可由胺基酸序列開始,循序依其複雜度分成四個層次。 1.1 一級構造: 像其它巨分子一樣,蛋白質鏈也是由小分子單位一個一個連接成的。 a. 蛋白質的長條胺基酸序列,是為其一級構造 (primary structure)。此一級構造的一端為 N-端 (-NH2),另一端為 C-端 (-COOH),而以 H2N-C-C-[N-C-C]x-N-C-COOH 為骨架,其中黑體字 C 代表各胺基酸單位的 a 碳。蛋白質習慣上都由 N-端往 C-端念。 ◆ 請練習畫出一長條胜肽的骨架,並任意加上各種胺基酸的基團。 b. 一級構造是蛋白質最終構形的根本,各級構造的訊息都決定於胺基酸序列;而胺基酸序列是根據 DNA 的核苷酸序列轉譯而來,故最終信息是記憶在細胞核的核酸。 c. 探討一級構造主要在分析該蛋白質之胺基酸序列,近來胺基酸序列多由該蛋白質的 cDNA 以分子群殖 (cloning) 篩選出來,再經核酸定序後轉譯成胺基酸序列。 (見 3.3) d. 除了構造之外,一段固定的胺基酸序列可能有某種特定的生理功能,稱之為 signal peptide (信息序列),同一 signal 可以在許多不同的蛋白質分子上重複出現。 例如蛋白質在 C-端若有 Lys-Asp-Glu-Leu (KDEL) 的序列,就會被回收到內質網去。 ◆ Scientific American: A Cellular Zip Code (1999 諾貝爾生理獎 Gunther Blobel)
1.2 二級構造: 蛋白質長鏈捲繞成堅固而規則的二級構造,是其最終構形的基礎單位。 1.2.1 二級構造相當規律: 胜鍵的雙鍵性質形成胜鍵平面,又因每個 a 碳上的 R 基團與前後相鄰基團的引力或斥力,使得兩相鄰胜鍵平面之間的轉動,限制在一定的角度範圍,而造成兩種相當規律的構形:a 螺旋 (a helix)、b 長帶 (b sheet),是為二級構造 (secondary structure),它們的主要構成力量都是氫鍵。氫鍵在細胞內的角色不但重要,且分佈非常廣泛。 ◆ 請練習畫出一個胜鍵,標出胜鍵平面以及上面的各個原子。 a. a 螺旋︰每 3.6 個胺基酸捲繞一圈,成為右手旋的螺旋構造,但遇 Pro 則中止;由相鄰兩胜鍵平面所夾的角度,可以準確預測 a 螺旋或其它二級構造的生成 (Ramachandran Plot)。分子內氫鍵可在螺旋骨架間加上支架,更使得 a 螺旋成為圓筒狀,有堅固的構形,也是三級構造的主要組成單位。肌紅蛋白 由八段長短不等的 a 螺旋所組成。 b. b 長帶︰像彩帶的構形,多由數條彩帶組成,相鄰彩帶之間以氫鍵接合,編成一片堅固的盾形平面。依相鄰彩帶的 N→C 方向,可分為同向 (parallel) 及 逆向 (antiparallel) 兩大類。 b 長帶多由 R 基團較小的胺基酸 (如 Ala, Gly, Ser) 組成。 ◆ 請練習畫出上述的各種二級構造,注意其立體構形及氫鍵位置。 c. 其它螺旋構造:除了 a 螺旋外,也有其它方式的螺旋構造,但每一單位螺旋的胺基酸數目不同。當連續有數個 Pro (如 PVPAPIPP) 時,會捲成稱為 polyproline 的特殊螺旋,每三個胺基酸轉一圈,橫切面是正三角形。 1.2.2 連結性二級構造: a. Turn 轉折:連接 a 螺旋或 b 長帶時,胜肽鏈需做劇烈的轉折,以接近 180 度的方式折返,這些轉折點通稱為turns;其中 b turn 由四個胺基酸組成 (多含有 Gly),而 g turn 則由三個胺基酸組成,且必須由一個 Pro 造成主要轉折。Turns 多分佈在蛋白質的表面,也很容易誘生抗體。 b. 不規則形:除上述構造外,尚有構形不規則的片段,稱為不規則形。而在蛋白質分子兩端附近,其活動性較大,形狀經常變化,則為任意形 (random coil)。 1.3 三級構造: 蛋白質的三級構造大致捲繞成球狀 (globular),已是有特定構形的活性分子。 ◆ Molecular Visualization Resources 大家都可以在家以桌上型電腦看立體模型 (以 Jmol 觀覽巨分子的 3D 構造) ◆ OMM Exhibits 立體蛋白質結構博物館 (以 Jmol 觀覽巨分子的 3D 構造) 1.3.1 三級構造的組成力量: a. 分子內的二級構造再相互組合,構成完整球狀的三級構造 (tertiary structure);其構成的作用力有離子鍵、氫鍵、疏水鍵、金屬離子等作用力;其中疏水鍵對水溶性蛋白質三級構造之穩定性,貢獻很大。 b. 水溶性蛋白質的核心緊密,多由疏水性胺基酸組成。由於疏水性胺基酸為外界水環境所排斥,可以穩定地包埋在分子內部,維持蛋白質的完整三級構造。 c. 蛋白質分子內兩個 Cys 上的 -SH 可經氧化而成雙硫鍵 (-S-S-),雙硫鍵可加強蛋白質的立體構造。在細胞中,雙硫鍵的形成可能需要靠酵素的催化。 1.3.2 三級構造的立體構成: a. 某些二級構造經常會聚在一起,例如 aaaa, bab 或 a8b8 筒狀構造等,而且經常出現在不同蛋白質中,可視為一種二級構造的再現單位 (motif 膜體)。這些再現單位可能對蛋白質的構造及其功能,有某種特定的貢獻。 b. 很多蛋白質在其三級構造中,可發現還會分成幾個獨立的小區域,每個區域稱為 domain (功能區塊)。較小的蛋白質通常只有一個 domain,大形蛋白質則含有兩個以上 domains。同一類似的 domain 可能經常重複出現在不同蛋白質,有其特定功能;domain 可能早期是獨立基因,後來因為基因之複製與組合,與其他功能的 domain 組成新的蛋白質。 c. 建構蛋白質最終立體構形的藍圖,其資訊還是貯藏在一級構造的胺基酸序列當中;因此某些蛋白質 (例如RNase) 在變性後,仍然可以回復原來的原態 (native) 立體構形,稱為復性。 d. 但並非所有的變性蛋白質都可如 RNase 般復性回原態分子,細胞內有一類巨大分子稱為 chaperonin,可以幫助蛋白質在轉譯時,正確地摺疊成原態分子。 e. 若已知某蛋白質的胺基酸序列,則可以電腦運算預知 a 螺旋、b 長帶或轉折等二級構造,相當準確。但更複雜的三級立體構造,目前則不容易預測準確。 ◆ The PredictProtein Server (EMBL 的一個蛋白質構造預測中心) 1.3.3 三級構造的修飾: a. 很多蛋白質的基本三級構造,即為獨立而具有活性的分子;但有些則要再加上輔脢、輔因子 (如金屬離子) 或輔基 (prosthetic group, 例如肌紅蛋白中的 heme)。有些則要再修飾以糖分子成為醣蛋白 (glycoprotein);脂蛋白 (lipoprotein) 要連接脂質。有更多要再與其它蛋白質結合,形成四級構造 (如四元體的血紅蛋白)。 b. 有些蛋白質的胺基酸長鏈,要先經過切斷或刪除部份胜肽後,才能有活性 (如胰島素)。胰島素是由一條基因轉譯出來的,切成三段後,其中兩段以雙硫鍵結合成具活性的三級構造,並非四級構造。這也是蛋白質活性的調控方式之一。 (參考 酵素 6.1) 1.4 四級構造: 有些蛋白質再聚合成四級構造,以調節其自身的功能,或組成巨大的結構分子。 a. 若數個相同或不同的三級構造分子,再結合成一較大的複合體,才能進行完整的活性功能,則稱為四級構造 (quaternary structure)。構成四級構造的每一單位分子,稱為次體 (subunit),通常各次體之間是以二級鍵為主要結合力量。請注意,每單位次體都是由一個獨立的基因所轉錄、轉譯出來的。 b. 若四級構造的任一次體與受質結合之後,會誘導增強其它次體與受質之結合能力,而加速反應,則稱為正協同作用 (positive cooperativity),反之為負協同作用。四級構造在調控蛋白質的活性上非常重要,許多酵素是重要例子,但典型具四級構造且有複雜調控機制的血紅蛋白並非酵素。 c. 病毒的蛋白質外殼,或動物的肌肉、毛髮、角質等,具有規律而巨大的構造組成。
|
|
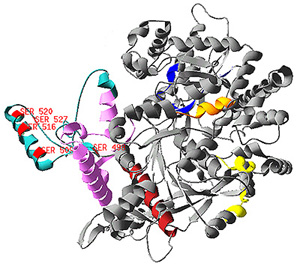
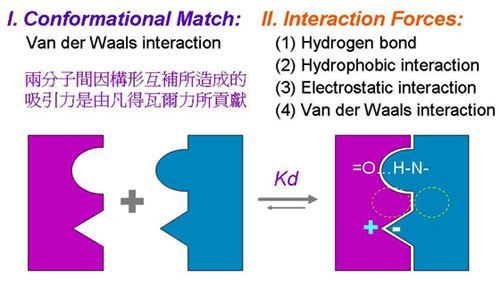
2 蛋白質性質:蛋白質要有正確的分子構形,才能有效執行其生理功能;構形或許是分子演化的基本驅策力,因為即使胺基酸序列不十分相似,同功能的蛋白質也可能有相同的構形 (各種生物的血紅蛋白即為一例)。 2.1 變性及復性: 某些條件會破壞蛋白質分子的各級構造,稱之為變性 (denatuaration),例如加熱、pH 太高或太低、尿素、界面活性劑、劇烈震盪等。變性的蛋白質大多會失去活性,當變性條件除去後,有些蛋白質會回復原來構形,並具原有活性,稱之為復性。 2.2 蛋白質構形是活動的: 蛋白質分子上的各部份結構並非固定不動,而是有相當的彈性與運動。尤其 domain 與 domain 之間,或者酵素催化區的開閤,都有相當大的活動幅度。這種活動會隨著溫度升高而上升,對蛋白質或酵素的活性及其調控有很大的影響。 2.3 蛋白質的專一性結合: 專一性在酵素的催化及細胞生理功能上,扮演重要角色。蛋白質與蛋白質之間,或與其它分子間,經常有專一性的結合,其構成原因如下: a. 構形互補 (conformational match):兩分子之間的接合表面,若其形狀互補 (像拼圖積木),則此接面衍生無數凡得瓦爾鍵結,產生可觀的吸引力量。 b. 二級鍵吸引力 (interaction forces):是在兩分子之結合面上,相對應胺基酸間產生吸引力量,多由二級鍵構成。 圖 1 是一假想圖例,說明某酵素與其抑制因子間,如何進行專一性的結合。 圖 1 蛋白質分子間的專一性結合力量是如何構成的 |
[投影片 P5]
↓
↓
↓
|
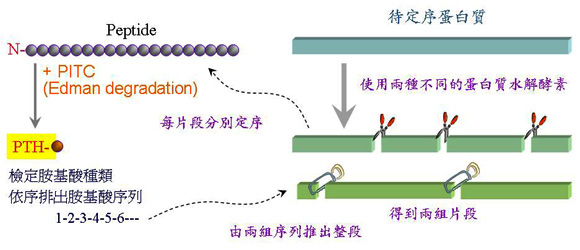
3 蛋白質研究技術:研究蛋白質通常要先純化得均質蛋白質,然後檢定其分子量、次體組成及等電點,最終則要定出蛋白質之胺基酸序列,或其立體三次元分子構造。 3.1 蛋白質純化技術: 利用蛋白質分子量不同、表面帶電性或極性區域大小等性質差異,可分離純化之。通常以能夠純化出大量均質蛋白質為目標,但最近的純化觀念已稍有改變,以二次元電泳 (或加上轉印),直接挖出單一色點的蛋白質,即可馬上付諸分析。 a. 硫酸銨分劃法:在蛋白質水溶液中加入硫酸銨等鹽類,會導致蛋白質因疏水性區域相吸引而聚集沉澱出來,稱為鹽析 (salting out);鹽析可大略地純化出蛋白質,並可以除去核酸、醣類或脂質等物質。 b. 膠體過濾法 (gel filtration):依蛋白質分子量的大小不同,先後分離出來。 c. 離子交換法 (ion exchange):各種蛋白質的帶電性強弱不同,與離子交換介質間吸引力的大小會有差異,可以此進行分離。請複習蛋白質的帶電性,會因環境的 pH 不同而有改變。 d. 親和層析法 (affinity chromatography):利用分子間專一的親和性,來吸引純化某蛋白質,最為直接;但並非所有蛋白質都能夠找到專一性的吸著劑。 3.2 蛋白質性質與構造檢定: a. 蛋白質定量法:染料 Coomassie Blue 與蛋白質結合後,會由褐色變為藍色;由反應前後藍色吸光度的改變,與已知蛋白質的標準曲線比較,即可推知樣本中蛋白質的濃度,顏色越呈現藍色,表示蛋白質含量越高。一般稱之為 Bradford method。 b. 分子量測定法:可利用膠體過濾法、超高速離心法 (ultracentrifugation) 或膠體電泳法 (gel electrophoresis) 來測定蛋白質的原態分子量; SDS 膠體電泳則可測定次體分子量。電泳同時可以檢定蛋白質的純度如何,是解析力極佳的分析工具。 c. 等電點 (pI):等電焦集法 (isoelectric focusing) 類似膠體電泳,但可測得蛋白質的等電點。等電點是蛋白質帶電性質的重要指標,當環境的 pH 等於其等電點時,此蛋白質的淨電荷為零;大於其等電點時,淨電荷為負,反之則帶正電荷。 d. 胺基酸組成:蛋白質以鹽酸水解成游離胺基酸後,再以離子交換法 (HPLC) 分析各種胺基酸之含量,即可得知各種胺基酸的含量百分比。 e. 蛋白質立體構造:以 X 光繞射法分析蛋白質結晶,可計算出分子的細微立體構造;近來也可應用核磁共振法 (nmr) 測定水溶液中蛋白質的立體構造。 f. 質譜分析:目前的質譜儀分析技術,已能輕易處理分子量較大的蛋白質,定出蛋白質的精確分子量;也可以分析蛋白質所列解的片段,並推出其胺基酸序列。 (3.3.3) 3.3 胺基酸序列決定法: 胺基酸的序列是一個蛋白質最根本的資料,只要定出其胺基酸序列,就可以推出相當多的生化性質。 3.3.1 傳統胺基酸定序法: 傳統的胺基酸定序方法,是直接檢定胜肽鏈上的胺基酸種類,如圖 2 的說明:
圖 2 蛋白質的胺基酸定序策略及 Edman degradation PITC (phenylisothiocyanate) 對蛋白質的 N-端胺基酸進行修飾,產生 PTH-胺基酸,並由 N-端掉落,可經由 HPLC 檢定是何種胺基酸。 a. 許多化學反應 (如 Edman degradation) 可由蛋白質的 N-端開始,依序一輪切下一個胺基酸,再檢定每輪切下的胺基酸為何,即可推得此蛋白質的胺基酸次序。 b. 若蛋白質太長,則無法有效定序後面的胺基酸序列;要先用 蛋白質水解脢 把目標蛋白質切成小段,各小段分別定序,然後再組合成長鏈。 c. 為了排列上述各小段胜肽的先後次序,要使用兩種不同的蛋白質水解脢,得到兩套不同長短的胜肽,分別定序後,比較各片段的重疊部分,即可判斷先後。 3.3.2 cDNA定序: 以基因操作方法,選殖出目標酵素的 cDNA,並將其核酸序列定出,則可推出所對應的胺基酸序列。目前大都採用此種方法,比較方便。 3.3.3 以質譜儀定序: 質譜儀是利用分子的質量大小來檢定樣本,因此可以精確測出分子的質量。若把蛋白質在質譜儀中撞擊,產生一群具有各種不同長短的片段,每一片段都剛好少一個胺基酸,然後用質譜儀一一測出這些片段的分子量,由所得各種片段分子量的差別,就可推出相差胺基酸的種類,乃至整段胺基酸的序列。 |
|
問題集 以下題目不一定有標準答案,甚至會引起很大的爭議,但這就是問題集之目的。1. 血紅蛋白 (hemoglobin) 為四元体,而肌紅蛋白 (myoglobin) 為單元体,請就兩者分子構造上的差異,說明其生理功能。 2. 請問有哪些方法可以定出蛋白質或胜肽的胺基酸序列? 3. 現在 DNA 操作技術很成熟,可以把蛋白質上的某胺基酸換成別種胺基酸。若有一個蛋白質,其分子上的某個 Leu 被換成 Val,並且某個 Lys 被換成 Arg,請問對這個蛋白質的活性影響如何? 4. 疏水鍵 (hydrophobic interaction) 對蛋白質的構造有何重要貢獻? 5. 鐮形血球 (sickle cell) 是如何造成的?有沒有補救或醫治的方法? 6. 構成蛋白質各級構造的各種鍵結力量中,有哪些是共價鍵? 7. 尿素 (urea) 可以破壞蛋白質的構造,請解釋可能的原因。 8. 蛋白質為何需要組合若干個三級構造的單元體,以形成一個更複雜的四級構造? 9. 氫鍵是構成蛋白質二級構造的主要力量,三級構造的組成也含有氫鍵,請問這兩類氫鍵有何不同之處? 10.有一段蛋白質的胺基酸序列如下,請預測這段蛋白質可能的構造特徵。 -LVRILNRILFFLWKTLTR- 11.蛋白質構造中的 domain 是什麼?有何重要的功用? 12.請判斷並說明下列各題的真偽: a. 構成 a 螺旋及 b 長帶的主要力量都是氫鍵。 b. 氫鍵一定要以氫原子居中架橋。 c. 構成三級構造的主要力量是氫鍵、疏水鍵、雙硫鍵、離子鍵。 d. 構成四級構造的力量是雙硫鍵。 e. 蛋白質四級構造的存在,只是為了數個蛋白質分子可以聚集在一起。 f. Sanger 發明了 DNA 定序方法;而 Pauling 發現 double helix。 g. 每種蛋白質都有其特定構形,而構形是根基於其一級胺基酸序列。 h. 蛋白質的三級立體構造完全可以由一級構造推算得之。 i. 解讀蛋白質的胺基酸序列,可得知序列與分子功能間的對應關係。 j. 不規則 (irregular) 構造多在分子兩端,沒有固定形狀,有很大自由度。 k. 所有具有功能性的蛋白質都是由一條完整胺基酸長鏈所構成的。 l. 蛋白質長鏈上的 a 螺旋構造遇到 Pro 就會中止。 m. 各種生物血紅蛋白的胺基酸序列相同,因此其構形相似,都保有同樣運氧功能。 n. 水溶性蛋白質的疏水性胺基酸大都在分子的內面,分子內部不可能有親水性的胺基酸,以防分子變性。 o. 二級鍵的力量太弱,很難對分子間的專一性吸引力做出實質貢獻。 p. Domain 可重複出現在不同分子構造,這是在基因層次已安排好的。 q. 所有蛋白質在變性後,都可因變性原因的去除,而恢復原態,稱為復性。 r. 加熱煮沸可以使蛋白質完全變性,包括雙硫鍵的斷裂。 s. 尿素可致蛋白質變性的原因是破壞 a 螺旋的氫鍵。 t. 一條 pI 為 5.2 的蛋白質,在細胞內可帶淨負電荷。 13.是非選擇題 (答案寫在□內,是→○、非→╳) 1) 有關 a helix 的性質: □ 我們可以由胺基酸的序列預測 a helix 的形成 □ 是由 Watson 及 Crick 所發現 □ 最常見的 a13 helix 是每 13 個胺基酸轉一圈 □ a helix 遇到 Pro 則中止 2) 蛋白質二級構造的成因: □ 胜肽鍵是平面構造 □ 胜肽鍵前後 R 基團的大小限制 □ 胜肽鏈的氫鍵吸引力 □ 胜肽鍵前後 R 基團的電荷限制 3) 有關蛋白質四級構造的性質: □ 有些蛋白質沒有四級構造 □ 四級構造是以共價鍵連結的 □ 有四級構造的蛋白質都具有調節作用 □ 血紅蛋白是同質四元体 4) 蛋白質的胺基酸序列: □ 可決定最後蛋白質的構形 □ 可能由 DNA 的任何一股譯出 □ 並不能顯示兩相關蛋白質間的演化關係之遠近 14.構成蛋白質三級構造的力量: 1____________ 2____________ 3___________ 15.請寫出六個以上使蛋白質變性的方法。 16.請說明以下人名:Sanger, Anfinsen, Pauling, Edman, Kendrew & Perutz 17.鑲在細胞膜上的許多蛋白質,其構造都有相當的相似性,多數由若干條 a helix 來回穿梭細胞膜而組成的。請問為何多採用 a helix? 18.在生物體內,兩個細胞之間經常要進行訊息的傳遞,例如兩個神經細胞之間,是以神經傳導物質做為神經衝動的傳遞媒介。除此之外,兩個細胞可以利用蛋白質做為細胞間連絡的傳遞物質;其信息的傳遞,是由一個細胞傳到另一個特定的目標細胞。而此等細胞之間,可能距離相當遠 (例如由腦部傳到胰臟),也可能有直接的接觸 (如免疫細胞間的辨認)。請利用蛋白質構造的特性,說明這兩種具有專一性的細胞信息傳遞及接收方式,是如何達成的?
|
|
|
|