|
教 學 主 題 |
||
|
細胞融合與單株抗體 |
||
|
Cell Fusion and Monoclonal Antibodies |
||
▼ 目錄.基礎免疫學.為何要使用單株抗體.細胞融合法.總 結.其 他.References ▼
(若連結至外部網頁則另開新視窗)
|
|
|||
|
|
|||
| 1 基礎免疫學: | |||
|
1A) 脊椎動物的免疫系統可催毀入侵物體 |
|||
|
1B) 後天免疫反應的四個階段 |
|||
|
1C) 後天免疫反應的兩大特點 |
|||
|
1D) 抗體是由 B 細胞所分泌的蛋白質 |
|||
| 2 為何要使用單株抗體: | |||
|
2C) 一個 B 細胞只會生產一種抗體 |
|||
|
2D) B 細胞無法在培養基中生長 |
|||
|
2E) 癌細胞可在培養基中永久生長 |
|||
|
2F) 利用細胞融合法可以結合兩種特性 |
|||
| 3 細胞融合法: | |||
|
3A) 小白鼠免疫及脾臟細胞 |
|||
|
3B) 骨髓癌細胞 |
|||
|
3C) 細胞融合 |
|||
|
3D) 細胞融合的注意要點 |
|||
|
3E) 篩選方法 |
|||
|
3F) 抗體生產 |
|||
| 總 結: | |||
| 其他相關技術: | |||
| Reference | |||
|
|
|||
|
上課時間 |
||||
|
講習&實習 |
抗體生產與應用 |
107-1 張世宗老師開課 (莊榮輝負擔部份講習課) |
||
|
講習課程 (停) |
單株抗體 (1) |
每學年 下學期開課 (接續下面的實驗課程) |
||
|
實驗課程 (停) |
免疫學技術 (2) |
每學年 暑期開課 共 18 週 上課課程表 |
||
|
(若有需要製備單株抗體者,請選修上述課程) |
||||
|
上課相關資料 |
||||
|
(1) 本課程講義文字檔 MS Word (mAb.doc 或 pdf ) + 上課投影片檔案下載 pdf (32 pages, 3 Mb) |
||||
|
(2) 免疫化學:酵素分析方法 Ana 8.3 問題集 8-15 題 + 投影片檔案下載 pdf (27 pages, 4.4 Mb) |
||||
|
簡要說明單株抗體流程 [mAb chart.ppsx] (若你沒有很多時間,請看此檔案) pdf (1 page, 0.4 Mb) |
||||
|
|
||||
|
1A) 脊椎動物的免疫系統可催毀入侵物體: |
||
|
免疫反應分成 先天 及 後天 兩大系統,又各有兩種方式,分別以 細胞 或 分子 去掃除入侵物。 當入侵物太多時,即由先天免疫系統誘發後天免疫,開啟了更具專一性、更為強大的防禦機制。 |
||
|
|
||
|
|
||
|
一些代表性先天免疫防禦細胞或分子: |
||
|
干擾素: 遭病毒攻擊的細胞會放出干擾素,干擾素會活化免疫系統。 |
||
|
溶菌脢: 在體表及淚液中溶解細菌細胞壁。 |
||
|
巨噬細胞: 最基層的免疫細胞,是免疫系統的第一線防禦。 |
||
|
自然殺手細胞: 可清除體內的癌細胞,是免疫監視系統。 |
||
|
|
||
|
|
||
|
遭遇: 巨噬細胞把抗原分解成小片段,專一地表現給 TH 細胞。 |
||
|
動員: TH 細胞動員 TK 細胞及 B 細胞,後者生產專一性抗體。 |
||
|
掃蕩: 抗體及 TK 細胞攻擊入侵的抗原。 |
||
|
休止: 完成清除抗原後,免疫細胞休息。 |
||
|
|
||
|
|
||
|
|
||
|
1C) 後天免疫反應的兩大特點: |
||
|
專一性: 由 甲抗原 所誘導的免疫反應只對 甲抗原 有效。 |
||
|
記憶性: 痊瘉後若 甲抗原 再度入侵,可迅速動員掃蕩之。 |
||
|
|
||
|
|
||
|
|
||
|
因為有上述兩種特點,因此當重複感染同一種抗原時,會有下面幾種現象: |
||
|
初級反應 primary response: 當抗原首次入侵,細胞經歷以上四個免疫反應階段,產生記憶細胞。 |
||
|
次級反應 secondary response: 抗原再次入侵,由記憶細胞啟動免疫反應,較快速且強勁。 |
||
|
Class switching: 初級反應先生成 IgM,抗體的親和力較低,次級反應則轉成 IgG,親和力大增。 |
||
|
親和力成熟 affinity maturation: 同一抗體基因由 IgM 轉成 IgG ,是經由 體細胞突變。 |
||
|
|
||
|
|
||
|
|
||
|
抗體分子: 由四條蛋白質長短鍊所組成 (兩重兩輕)。 |
||
|
結合區: 抗體分子上有兩個抗原結合區 (二者相同),結合區的 變異性 很大,以對抗種種抗原。 |
||
|
專一性:
抗體與抗原結合極具
專一性
(如
lock & key
般吻合)。 |
||
|
抗體種類: IgG 是單一抗體分子,另有 IgM (五元體) 及 IgA (二元體)。 |
||
|
|
||
|
|
|
|
|
|
||
|
|
||
|
抗體的輕鏈與重鏈是由不同的基因所轉譯出來,兩者各由許多基因片段經過重組而成。如上圖輕鏈的基因由 V, J 及 C 三大群所組成,各群擇一組成最後表現出來的 mRNA,然後轉譯成蛋白質。這樣的重組,可形成很多不同的組合,也是抗體能夠對無數抗原產生專一性結合的主因。 |
||
|
|
||
|
|
||
|
抗體基因以幾種機制來達成其多樣化之目的,以便產生足夠的抗體,來對抗環境種種不同的抗原。(1) 其基因本身,就有許多不同的選擇,可有不同的組合,使得變異區多樣化;(2) 然後,這些基因片段的組合點不很精確,可增加變異性;(3) 這樣所組合出來的基因,又會進行體細胞的突變,在超變異區 (HV) 特別容易突變;(4) 輕重鏈都有以上的變異機制,然後不同輕重鏈又可隨意組合。 |
||
|
|
||
|
|
|
2A) 一個抗原分子可能含有許多抗原決定基: |
||
|
抗原分子上可以誘導出抗體的部位或片段,特稱之為 抗原決定基 (antigenic determinant);一個抗原分子上通常都有許多處抗原決定基,而每個決定基至少都可誘生出一種抗體;因此在傳統抗血清中,都含有許多種不同的抗體,分別對抗這些不同的決定基。 |
||
|
|
||
|
|
||
|
免疫系統產生專一性抗體的流程,大致如上圖所示。當抗原初次入侵,由巨噬細胞把抗原呈現給 T 細胞,並由 TH 細胞挑出可產生專一性抗體的 B 細胞。最先被挑出來的 B 細胞,其所產生的抗體可能專一性並不很好,但是若抗原再次入侵,擇會誘使此 B 細胞的基因發生 體細胞突變,產生很多種變異子代細胞,他們所產生的抗體親和力有各種變化,但只有親和力最好的才會被挑選出來。注意如此產生的抗體,只對原來的抗原有專一性結合,若抗原突變或者外殼偽裝起來,就無法辨識。 |
||
|
|
||
|
2B) 傳統抗血清對相似抗原會有交叉反應性: |
||
|
對於分子構造相似的抗原,由於它們含有共同或相似的抗原決定基,所產生的抗血清對這兩種相似的抗原都會產生反應;因此在檢定此類抗原時,其 專一性 不很理想,常常會出現假陽性,也稱為 交叉反應性。 同時又由於免疫動物的個別體質不同,對抗原的反應也有相當的差異,以致無法準確控制所得到每批抗血清 效價 的高低。 |
||
|
|
||
|
|
||
|
|
||
|
2C) 一個 B 細胞只會生產一種抗體: |
||
|
血清中的每一種抗體是由單一種 B 細胞 所分泌產生,若能把此 B 細胞由脾臟中挑出來,單獨培養成細胞株,則可得單一種類的抗體,只會對一種 抗原決定基 反應,其專一性極高。 大量培養此細胞株,即可有品質一定、純度均一的抗體,此即為 單株抗體。 |
||
|
|
||
|
|
||
|
2D) B 細胞無法在培養基中生長: |
||
|
然而 B 細胞不易在培養基中生長,雖然有人一直努力,想找出在體外培養脾臟細胞的條件,但結果均不甚理想,因此上述想法不易達成。 (請見 下圖 中央的 4 號 B 細胞,X 表示無法培養) |
||
|
|
||
|
|
||
|
2E) 癌細胞可在培養基中永久生長: |
||
|
癌細胞 很容易在培養基中生長,有很多已經建立好的癌細胞株,其生長之特性均已瞭解; 若把癌細胞永續生長的特性,利用細胞融合法導入可生產有用抗體的 B 細胞 中,則得到可在培養基中永久生長的 B 細胞株,此即 融合瘤 細胞株。 (請見 上圖 右半部及下圖說明) |
||
|
|
||
|
|
||
|
|
||
|
2F) 利用細胞融合法可以結合兩種特性: |
||
|
廣義來說,細胞融合也可說是
基因重組 的一種方式,它是以融合兩種不同遺傳特性的細胞,來達成改變遺傳形質的目的。
另外,微生物或植物的細胞,亦可以
原生質體 的形式互相融合,以改變其遺傳性質。
|
|
|
 |
||
|
|
||
|
利用 polyethylene glycol (PEG) 進行小白鼠 脾臟細胞 (3A) 與 骨髓癌細胞 (3B) 的 融合 (3C),經過 篩選 (3E) 及 單株化 後,可得到分泌有 單株抗体 (3F) 的融合瘤細胞。實際操作方法可參考 莊榮輝 博士論文 (1985) 88~105 pdf 。 |
||
|
1) 小白鼠 (balb/c) 先以 目標抗原 (如菌體) 免疫,抗原需加 佐劑 (adjuvant, 如 TiterMax) 製成乳劑,打入小鼠體內 慢慢釋出 (免疫流程),誘使 B 細胞成熟增殖並生產抗體。 試採血 確定有抗體產生後,即可取出 脾臟 以收穫 脾臟細胞 (大多為 B 細胞) 與骨髓癌細胞進行 細胞融合。 |
||
|
2) 注意乳劑的生產要完全,可取小量滴入水中,震動後應該不會散去。 也可以在 電泳後,切出所要色帶,膠體裝入乳化針筒,加入佐劑 直接製成乳劑,可有相當好的免疫效果。 |
||
|
3) 抗原 種類與來源 也很重要,與小鼠親緣越遠的分子,越容易產生抗體。 通常抗原都是蛋白質,但是多醣類也相當容易誘生抗體,核酸比較不容易直接產生免疫反應 (或者如下所述,採用 DNA 疫苗免疫方式)。若知道抗原分子的胺基酸序列,可以用電腦找出最具抗原性的片段,大約 10~20 個胺基酸長度,以人工合成出來後接到大分子 carrier 上,經免疫動物誘生抗體,稱之為 單專一性抗體 (monospecific Ab)。 |
||
|
4) 有人直接取出健康的脾細胞,在培養中加入抗原進行體外免疫;或打開腹腔直接在脾臟注射抗原免疫。 近來更流行以抗原的 DNA 種入肝臟中,以此 DNA 的表現產物,直接在生物體內誘發免疫反應 (DNA vaccine)。 但除非抗原來源困難或有其它目的,我們仍採行舊法,因免疫反應的啟動機制非常複雜,生物整體的免疫反應還是最可靠。 |
||
|
5) 注意抗原的用量要適當,抗原用量太高,反而無法誘導出高親和力的抗體。 |
||
|
|
||
|
|
||
|
NS-1 是穩定的小白鼠 BALB/c 癌細胞株,除了能在培養基中永續生長外,尚有一重要特性,其細胞缺乏兩種核酸代謝的重要酵素 (TK, thymidine kinase 及 HGPRT, hypoxanthine-guanine phosphoribosyl transferase)。一般細胞內的核酸合成路徑有兩條,如下圖所示: |
||
|
|
||
|
核酸的 正常代謝途徑 若被 aminopterin 阻礙,可由 救急途徑 (salvage pathway) 取用 thymidine (T) 及 hypoxanthine (H) 來合成 DNA。但 NS-1 缺乏 TK 及 HGPRT 兩種酵素,因此在 aminopterin (A) 存在下 NS-1 無法生長;正常細胞 (如 B 細胞) 則可經救急途徑繼續生長。HAT 培養基含 aminopterin, thymidine 及 hypoxanthine,NS-1 在 HAT 中無法生長,除非經由細胞融合導入 TK 及 HGPRT 兩酵素的基因 (可由正常脾臟細胞得來)。 |
||
|
|
||
|
|
||
|
小白鼠脾臟細胞 B 與 NS-1 細胞 N 以 PEG 進行融合,操作在 10 min 內完成 (如下圖),隨即把細胞平均分配在 96 槽細胞培養盤 中 (上圖)。 |
||
|
|
||
|
|
||
|
由於融合是隨機的,故可能的組合有:B-N, B-B, N-N, B-B-B, B-B-N....;只有同時含有 B 與 N 的融合細胞才會活下去: |
||
|
|
||
|
|
||
|
1) 若只含 NS-1 (N, N-N.....),則在 HAT 中會因 DNA 合成抑制而死亡。 |
||
|
2) 若只含脾細胞 (B, B-B, B-B-B......),則在體外培養會漸漸死去。 |
||
|
3) 可能活下去的細胞 (B-N, B-B-N, N-N-B.....) 含有來自兩方的染色體,同源染色體可能發生基因重組,互換遺傳訊息;接下去的細胞分裂會排除多餘的染色體,一直到只剩一組染色體時才告穩定。在初期的分裂增殖過程中,失去含有重要基因染色體的子細胞可能會死去。成功穩定的融合細胞株會經由染色體的重組,得兼有雙方的特性:即可分泌抗體,亦可在培養基 HAT 中生長下去。 |
||
|
|
||
|
3D) 細胞融合的注意要點: |
||
|
1) NS-1 要健康,在 T-80 培養瓶內生長密度不要超過六成,一瓶 T-80 細胞用在一次融合。脾細胞取出後可以不用除去紅血球,直接以 RPMI 洗三次,要小心自行調整 離心力 不致太大,也不能太小,隨時鏡檢之。 |
||
|
2) 要用可靠的 PEG 1500,可使用商品已配置好的溶液,每次 0.7~1 mL;否則自己要試出可用的批次,在高壓滅菌時,儘量縮短滅菌時間 (5 min 足夠),並且要儘速由滅菌釜內取出。 |
||
|
3) 把 NS-1 與脾細胞混合,每次使用一個 T-80 與一個脾臟,幾乎可以不用數細胞數目;在 50 mL 離心管中,小心把細胞離心下來,倒去上清後,以殘留的 RPMI 把細胞打散,放在 37℃內保溫準備加入 PEG。 |
||
|
4) 在 2 min 內慢慢加入 PEG,同時一邊輕輕搖動,讓 PEG 均勻地混合細胞。然後在 2 min 內加入 2 mL RPMI,邊加邊混勻 (如上圖);然後於接下來 2 min 內,再加 8 mL RPMI。此時鏡檢可看到許多細胞聚合,如下圖黑白照片;若在融合後 1 h 看不到很多融合細胞,可能已經失敗。 |
||
|
5) 離心去掉上清,輕輕加入 30 mL HAT-RPMI,均勻懸濁細胞。此步驟最為關鍵,離心力不可過大,以免把 剛融合的脆弱細胞壓成一塊;若你無法輕易而均勻地把細胞懸濁,就已經失敗。 |
||
|
6) 把細胞放在保溫箱 30 min 後,均分到三片 96 孔培養盤,每槽加三~四滴,分配要平均。 |
||
|
7) 從第二天起就不再用 HAT,改用 HT-RPMI 即可。添加或換培養液時,不要擾動細胞,並且不要在培養箱外面放置太久。 第二或第三天鏡檢可以看到很多二元體,是融合後的第一次分裂;這種二元體數目應該很多,培養槽內到處都會冒出來 (約 25 至 50 對),可以用『雨後春筍』來形容之,否則可能已經失敗。 |
||
|
8) 但細胞仍迅速死亡,最後每槽只剩下一或二個穩定細胞群落,約一週內可看到如下面彩色圖片所示的細胞堆,此時 開始進行 ELISA 篩選。 |
||
|
|
||
|
|
||
|
|
||
|
1) 初步篩選: 融合後馬上以 HAT 培養,能活下來的都是上述 B 細胞與 NS-1 的正確融合細胞,但此時細胞的 遺傳背景 尚未十分穩定。 |
||
|
2) 篩選專一性抗體: 並非所有 B 細胞都會產生我們所要的抗體,小白鼠原先就存在許多 B 細胞株對抗一般疾病;因此要用 酵素免疫分析法 (ELISA) 挑出專一性抗體 (請見下面圖解)。 |
||
|
|
||
|
|
||
|
|
||
|
4) 單株化 (次選殖 subcloning):這樣所挑出來的細胞株,也許仍含有兩群以上的細胞 (為什麼?),因此要進行單株化 。先將該細胞株稀釋,重新平分到 96 槽細胞培養盤中,計算使得每槽中只含一個細胞,俟其生長成群落後,再次以 ELISA 篩選專一性抗體。請見下圖次選殖流程。 |
||
|
|
||
|
|
||
|
單株化是要確定每個細胞株的純系,因為細胞可能還會變化,成為不產生專一性抗體者,如上圖最右邊的灰色 3 號細胞。一般使用限數稀釋法進行,細胞的數目可用 cell counter 數得,並且稀釋到所要的濃度,例如 每 mL 含有 100 個細胞,若只要取一個細胞放到一個培養槽中,那麼你應該吸取多少 mL? (0.01 mL) |
||
|
|
||
|
1) 可把挑選出來的融合細胞打入小鼠腹部,誘生腫瘤,然後以 針頭 收集所產生的 腹水,通常可取得 15 mL 左右;腹水中的抗體濃度非常高,每 mL 可達數 mg。 因為這個方法造成實驗動物極大痛苦,很多國家禁用;若非得使用不可時,要儘可能減低動物受苦。 |
||
|
2) 把融合細胞在大型培養槽中培養,收集培養液上清即得抗體,但每 mL 只得約數 mg,濃度較腹水稀約一千倍。最近有一種細胞培養瓶,可產生如腹水般濃度的上清,但價格極為昂貴。 |
||
|
3) 得到穩定的抗體後,通常要再以 ELISA 方法 檢定該抗體的 subclass 是屬於 IgG, IgM 或 IgA 等。 免疫時間太短的,較可能取得 IgM,但一般仍以 IgG 較多,注意 IgG 又可分成幾種 sub-subclass。 |
||
|
4) 所得到的抗體再經純化步驟,以除去雜質,可用下列各種方法的組合︰ |
||
|
硫酸銨分劃: 收集約 40% 飽和度的沉澱,是最經濟、方便的方法。 |
||
|
離子交換法: 用 DEAE 陰離子交換法,多用在純化 IgG。 |
||
|
膠體過濾法: 以分子量的差異分劃出各種抗體,多用在純化 IgM。 |
||
|
親和層析法: 以 Protein A-吸著劑 專一性地吸住抗體分子 (IgG)。 |
||
|
|
||
|
|
||
|
|
||
|
總 結: |
||
|
當單株抗體剛被發展出來時,人們因為它像 巡弋飛彈 般的準確性,而對其應用於 癌症的治療 方面抱以極高的希望;但是二十年來,並無突破性的進展。主要的原因,並不是單株抗體無法攻擊癌細胞,或者是單株抗體的專一性不夠;原因之一乃是癌細胞的變化實在太大,無法找出各種癌細胞的共同抗原,以製成通用的抗癌單株抗體。 雖然如此,單株抗體並沒有失去其科學上或醫療上的價值,它仍然是一個極為 有用的工具,可以辨認分子上細微的差異,而被應用在很多其他方面;是目前生物技術產業中,極重要且獲利率高的一項,尤其在未來的『蛋白質晶片』應用, 對整個 蛋白質體學 的研究,可能會有很重要的貢獻 (參閱:蛋白質體與單株抗體工具)。 近十年來,由於基因操作技術的發達,單株抗體因為其基因的修飾剪接,得以改造成各種形式,以致更適合於人體使用;同時,基礎醫學對癌症研究也有長足發展,單株抗體因此又受到重用,請見 Scientific American (October 2001): Magic Bullets Fly Again,是單株抗體的全新熱潮。 |
||
|
|
||
|
|
||
|
下圖是整個細胞融合及單株抗體生產的摘要流程: |
||
|
|
||
|
|
||
|
請注意為何使用傳統抗血清會有 交叉反應,而單株抗體如何克服此一缺點 (上圖右側部份);另外,上圖左側部份說明細胞融合方法,以及單株抗體如何篩選及生產。 pdf 下載 |
||
|
|
||
|
其他相關技術: |
||
| Phage Display | ||
|
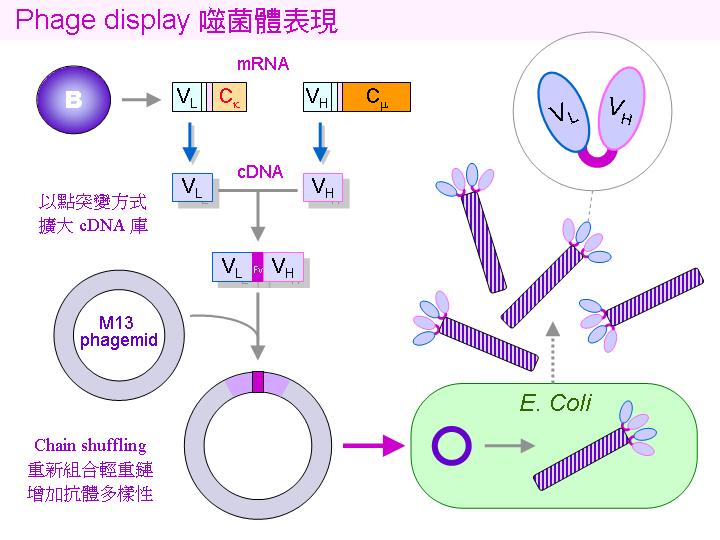
基因操作方法也可以應用在單株抗體的生產上,稱為 噬菌體表現 (phage display)。當單株細胞被挑選出來之後,可以分離出組成抗體 輕鏈 (L) 及 重鏈 (H) 的 mRNA,把他們的 變異區 (VL 及 VH) 逆轉錄成 cDNA 後,以連接片段 (Fv) 接起來,並植入噬菌體 M13 的外殼蛋白基因中,就可以去感染大腸菌,並且繁殖大量 M13 噬菌體,就會在其外殼表現出所植入的抗體 VL + VH 片段,這是抗體最重要的抗原結合區;因為這種片段保留了抗原結合區,但沒有其他的 Fc 部份,因此可以應用在很多方面。 |
||
|
|
||
 |
||
|
|
||
|
除了如上述直接表現出抗體的結合區之外,在製備 cDNA 的時候,可以用點突變 (結合 PCR) 的方式,隨機地改變任意鹼基以造成多樣性,可產生更多變的 cDNA 庫,再由所產生的突變蛋白質中,挑選可能的變種抗原結合區,也許有更強或較特殊的親和力。另外,利用基因片段的洗牌 (chain shuffling),也可以重新組合不同的輕鏈與重鏈,以求得到更好的組合。 |
||
|
|
||
| DNA Vaccine | ||
|
不使用蛋白質為抗原,改用其基因打入免疫動物的細胞核中,並在其細胞中直接轉譯出蛋白質,以便誘發免疫反應。請連結 生物技術 - 免疫治療法。 |
||
|
|
||
|
|
||
|
◆ Ezzell C (2001) Magic Bullets Fly Again. Scientific American 285 (Oct), 28~35 (單株抗體新熱潮) |
||
|
◆ Milstein C (1980) Monoclonal Antibodies. Scientific American 243 (Oct), 56~64 |
||
|
◆ Roitt I, Brostoff J, Male D (2001) Immunology. 6th ed, Mosby (最暢銷的基礎免疫學課本) |
||
|
◆ 實際操作方法可參考『水稻蔗糖合成 酶之研究』莊榮輝博士論文 (1985 台大農化系) 88~105 pdf |
||
|
◆ Richard A. Goldsby et al (2018) Kuby Immunology (4e) 免疫學課本 (Amazon) |
||
|
◆ 莊榮輝 (1984) 迷爾使呆與突魔大王 (單株抗體的童話故事) 台大農化 33, 65~69 |
||
|
◆ 莊榮輝 (1990) 細胞大戰 (人體免疫的童話故事) 台大農化 38, 54~58 |
||
|
建立日期:2000/4/15; 更新日期: 2018/09/19 |
||
|
本網頁資料隨時在編修中 © 版權所有 |
||
|
|
||
(若連結至外部網頁則另開新視窗)
本課程講義文字檔 MS Word (mAb.doc) 或 pdf
上課投影片檔案下載 pdf
簡要說明單株抗體流程 [mAb chart.ppsx] (若你沒有很多時間,請看此檔案) pdf

▲ 目錄.基礎免疫學.為何要使用單株抗體.細胞融合法.總 結.其 他.References ▲