|
|
|
|
酵素催化活性的化學本質 The Chemical Nature of Enzyme Catalysis |
|
|
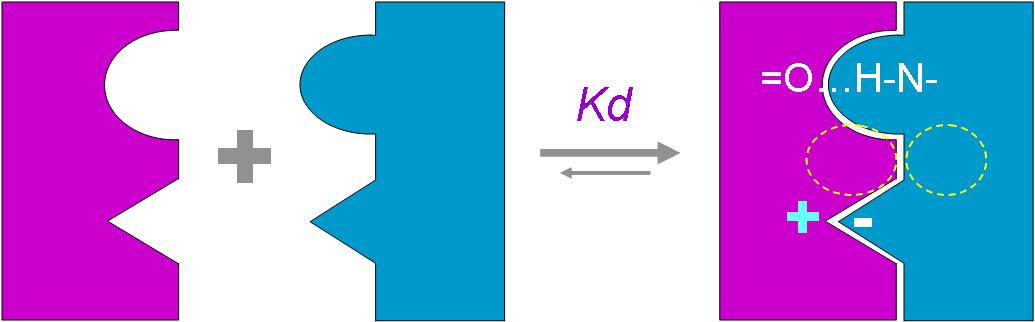
本主題討論酵素具有催化活性的基本原理,以蛋白質的分子構造為基礎,深入其化學鍵結與機制。 整個主題的代表性實例,就是研究得非常清楚的 chymotrypsin;請複習這個酵素的催化機制,其重點有: (1) catalytic triad 的形成與催化能力、(2) 順序式催化方式兩個步驟 acylation 與 deacylation 之每一細節、(3) 酵素如何穩定催化過程中的過渡狀態、(4) 酵素如何辨別其特異性基質。 然後檢驗你對此一機制的熟悉程度:請取出一張白紙,用筆逐一畫出上述各點,說明給另一位同學聽,並且相互討論。 |
|
|
上述的 chymotrypsin 催化過程,在網頁上有動畫,並且有酵素的相關基本資料,也收集有關酵素的純化與分析等說明文字,請隨時上網參考。 |
|
|
Chymotrypsin 動畫: http://juang.bst.ntu.edu.tw/BCbasics/Animation1.htm#Chy |
|