|
Q4 蛋白質檢定: |
TOP ▲ |
|
|
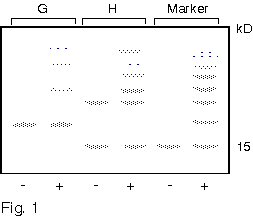
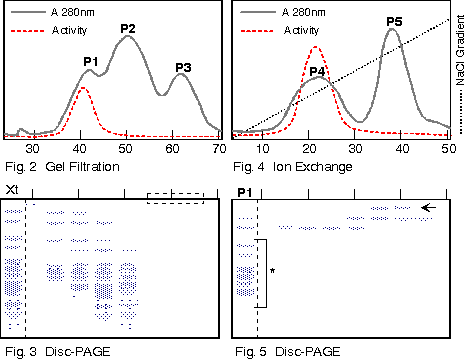
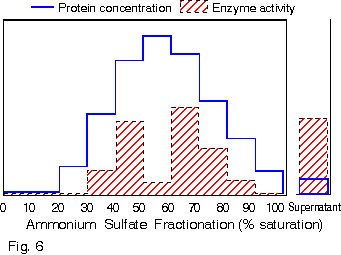
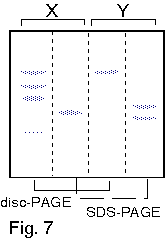
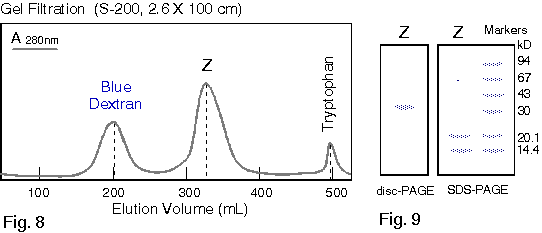
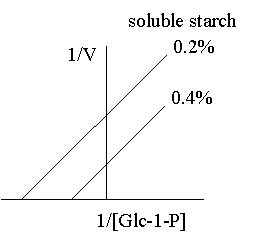
1. 你在純化得某酵素後,經定序得到其 N-端的 15 個胺基酸序列,請問接著可以進行那些實驗? 各有何目的或用途? 2. 請列表整理出所有決定分子量的方法,並比較其優缺點。 3. 電泳後進行蛋白質轉印,再用抗体染色後,結果: a. 發現除了標準品的藍色色帶存在之外,其餘各樣本空白一片,請問可能的原因。 b. 發現連標準品也都空白一片,請問可能的原因。 4. 若你的蛋白質 N-端已被乙醯化,無法進行胺基酸定序,則你將如何定出該蛋白質的部份序列? 5. 胺基酸組成分析可得知蛋白質中各種胺基酸百分比,但 Asn 會水解成 Asp,Glu 水解成 Glu;也就是說只能測得兩者的和 (以 Asx 或 Glx 表示),而無法直接測得 Asn 或 Gln 的量。 請問你如何可以推出所測得的 Glu (Asp) 中含多少 Gln (Asn)? 6. 為什麼只有 Edman 反應能夠應用在胺基酸定序? 而 dansylation 不行? 7. 免疫學書上提到,抗体可以與抗原結合而沉澱下來;但在生化應用時,此抗体都要附在一固相擔体上,才能做為免疫沉澱劑。 為何要如此麻煩,不能直接以抗体沉澱抗原? 8. 當群殖得某酵素的 cDNA 並已定序,但其活性分析方法極為困難,或根本不知此酵素的活性時,則在純化過程中,你有何方法可以追蹤此酵素? 9. 生產傳統抗体時,抗原純度一定要非常高,否則可能會有交叉反應;但在生產單株抗体時,反而可以用不很純的抗原去免疫動物。 請問這是如何進行的? 有何先決條件? 10. 澱粉磷解脢與 b-澱粉脢的基質都是澱粉,但兩者的催化反應不同,分子構造上也無相同之處。 當使用澱粉磷解脢為抗原製備單株抗体時,發現所得到的抗体有很多株 (約一半) 都會對 b-澱粉脢有交叉反應;反之以 b-澱粉脢為抗原所得的抗体,也有少部份對澱粉磷解脢會有反應。 請問這是如何造成的? 11. 蛋白質轉印後,以免疫染色所得色帶的深淺,可以做為定量的依據。 請問這樣的定量方法,有無可能的缺失? 如何改進或注意之? 12. 最近流行使用短鏈胜汰 (約十多個胺基酸) 連到 carrier 上做為抗原,進行免疫後可以得到抗体,稱為 monospecific Ab。 某生由其酵素 cDNA 序列轉譯的蛋白質序列上選出一段胜汰 (VALIWVVSAIL),以此進行抗体製備,結果也得到了抗体。 但發現此抗体在進行蛋白質轉印的免疫染色時,對 disc-PAGE 膠片的轉印膜無法呈色,呈一片空白;對 SDS-PAGE 轉印膜則只能看到很淡的色帶。 請問發生了什麼毛病? 如何解決問題? 13. 假設此生得到另一種完全不同的結果,免疫轉印得到很強的呈色色帶,但對細胞的粗抽取液樣本做檢定時,對不含此一酵素的控制組,卻也有免疫呈色,請問如何解釋? 14. 續上題,另一位同學則以電腦軟體搜尋較強的抗原決定基,選了該蛋白質 N-端的一段序列 (MILAKKSVALV),同樣進行抗体製備;所得抗體對細胞的粗抽取液樣本做檢定,結果在兩種 PAGE 膠片上預期的分子量處,看不到呈色色帶,但在預期分子量稍高處,隱隱發現有一很淡又很細的色帶。 這又是發生了什麼問題? 15. 請由下圖澱粉磷解脢動力學結果,解釋基質 (澱粉及Glc-1-P) 與酵素間作用的關係。 |
|
|
|
||
|
TOP ▲ |
||