|
4.2.1 |
蛋白質定量分析 |
|
| |
|
|
| |
Bradford
的 dye-binding method 是利用 Coomassie brilliant blue G-250
(CBG)
可與蛋白質結合而 變色
的特性來定量 (Bradford, 1976);若試樣中的蛋白質量較多,則結合到蛋白質而變色的
CBG
也多,因而呈色較深。下例是以一組標準蛋白質為對象,製作一條蛋白質量與吸光度的標準校正線。 |
|
| |
|
|
| |
儀器用具:
|
|
|
|
ELISA
光度計 (Dynatech MRX) 可在一分鐘內測完一片滴定盤
|

|
|
|
|
微量滴定盤
(microtiter plate, Nunc F96
Maxisorb
442404)
|
|
|
|
Micro
test tubes, 大頭針或噴火槍
|
|
| |
藥品試劑:
|
|
| |
(a)
Buffer A-0
|
|
| |
(b)
BSA 標準品 (Bio-Rad, bovine serum albumin, 100 mg/mL)
|
|
| |
(c)
未知濃度樣本 (unknown BSA, 0.8 mL, 由教師調配發給)
|
|
| |
(d)
Dye Reagent (Bio-Rad
500-0006) 先以水稀釋四倍備用
|
|
| |
u以染料
Coomassie brilliant blue G-250 配製的溶液,勿與 膠體電泳染色
用的 CBR-250
混淆,各有其使用上的特色,不要互用。
|
|
| |
標準品及樣本:
|
|
| |
標準品系列:
|
|
| |
使用小試管準備一組
BSA (b) 標準品的系列稀釋:
|
|
| |
|
Label
|
BSA
(b)
|
Buffer
A-0
|
Final
Conc. |
|
|
#5 |
500
mL
|
0 mL
|
100
mg/mL
|
混合均勻
|
|
#4 |
400
mL
|
100
mL
|
80
mg/mL
|
混合均勻 |
|
#3 |
300
mL
|
200
mL
|
60
mg/mL
|
混合均勻 |
|
#2 |
200
mL
|
300
mL
|
40
mg/mL
|
混合均勻 |
|
#1 |
100
mL
|
400
mL
|
20
mg/mL
|
混合均勻 |
|
#0
|
0
mL
|
500
mL
|
0 mg/mL
|
混合均勻 |
|
|
| |
u配製一定要精準,否則校正直線不會很準確;各種試劑的添加,若
自稀往濃 取樣,則可以不用換吸管頭。
|
|
| |
未知樣本:
|
|
| |
再以上述
unknown BSA (c) 準備兩種未知樣本:
|
|
| |
|
Label
|
未知樣本
(c)
|
Buffer
A-0
|
Final
Conc.
|
|
X1
|
500
mL
|
0 mL
|
2× |
|
X2
|
250
mL
|
250
mL
|
1/2×
|
|
|
| |
一般樣本:
|
|
| |
1)
通常由色析法所收集到的各分劃樣本,都可以直接進行蛋白質定量分析;但若其中含有某些干擾因子
(如含有 Triton ),或樣本的濃度太濃,都必須將樣本稀釋後再測。
|
|
| |
2)
同一樣本的若干不同稀釋濃度,所測出來的最終蛋白質濃度會有差異,通常是以
稀釋度大者 較為準確。
|
|
| |
方法步驟:
|
|
| |
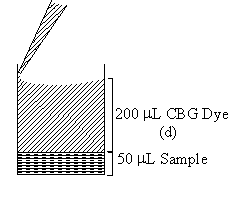
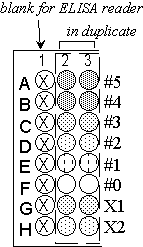
1)
每槽先加好 50 mL 標準品 (#0, #1 ....
#5) 或未知樣本 (X1, X2),以 二重複 加入 96
孔滴定盤中,如圖 4.3 所示。
|
|
|
|
|
F4.3 |
| |
|
|
| |
圖 4.3
微量滴定盤的使用
|
|
| |
|
|
| |
2)
每槽再加入200 mL Dye-Reagent (d),在全部樣本槽加完前,不要中斷添加;同時小心避免氣泡產生。
|
|
| |
u本步驟是實驗成敗的關鍵!
|
|
| |
3)
輕拍滴定盤一側,使添加的各成份均勻混合,注意
Dye-Reagent 密度較大,很容易沉積在下方而分層。
若還有小氣泡,小心以大頭針刺破,大量時可用噴火槍火燄燒破。
|
|
| |
4)
靜置室溫 10 min。
|
|
| |
5)
以 ELISA reader 測量 570 nm
(或 595 nm) 的吸光值。
|
|
| |
註解討論: |
|
|
|
a.
在作圖紙上畫出標準品的校正線,並決定未知樣本的濃度
(如圖 4.4 )。
|
|
|
|
b.
請說明本分析方法的原理,並特別以蛋白質構造來說明。
|
|
|
|
c.
一般緩衝液或試劑中,何種添加物會影響 Bradford
法的呈色?
|
|
|
|
d.
請列出本分析方法的各操作步驟中,哪些會影響分析的準確度?
|
|
|
|
e.
還有哪些蛋白質的定量方法?
並請比較其優劣點。
|
|
|
|
|
F4.4
|
|
|
|
|
|
|
|
|
|
|
圖 4.4
繪製標準品校正線
|
|
|
|
|
▲
|
| |
|
|
|
4.2.3 |
膠体電泳法 |
|
| |
|
|
| |
電泳
的高解析力使其成為生化技術中最有效力的一門分析利器,以下簡略說明各種電泳的形式及其應用。 |
|
| |
a.
不連續膠體電泳
(disc-PAGE)
是以原態蛋白質進行電泳,一般用作純度檢定或活性分析,SDS-膠體電泳
(SDS-PAGE) 則用為 次體分子量
之測定,梯度 (gradient)
電泳則可輔助原態蛋白質分子量之決定。 結合 SDS
及梯度兩種特性的 SDS-梯度膠體電泳,其解析力最高。 |
|
| |
b.
電泳形式
早期使用圓柱狀膠體,演變成直立式的平板膠片 (16 × 18
cm),最後改成迷你電泳膠片 (8 × 10 cm),電泳時間只約一小時,而其解析力不變。現在柱狀膠體電泳只用在等電焦集法,以進行二次元電泳;而大型平板電泳則多用在製備式電泳,一般電泳大多以迷你膠片進行之。 |
|
| |
c.
膠體材質
的種類很多,但用在蛋白質者則以 聚丙烯醯胺
(polyacrylamide)
為主;聚丙烯醯胺電泳是蛋白質應用最廣的電泳分析方式。也有少數使用洋菜膠體
(agarose gel),多用在測定 pI 較廣的異構脢酵素群。 |
|
| |
d.
泳動率: 在 pH
8.8 的電泳條件下,大部分 pI 小於 8.8
的分子均能往正極泳動;蛋白質的泳動率與所帶電荷成正比,而與其分子量成反比;若分子量一樣,但形狀越不規則,或體積越鬆散者,泳動率越小。 |
|
| |
e.
SDS
電泳
雖然分有原態的 disc- 及變性的 SDS-PAGE 兩種,但兩者除了
SDS-PAGE 在整個系統含有 0.1% SDS
之外,其餘完全相同,且其鑄膠及電泳方法均屬大同小異。 |
|
| |
f.
原態 disc-PAGE
中的樣本蛋白質,因電泳系統中不含界面活性劑 SDS,其活性多能保持,可以在膠體上做活性染色。
若目標酵素沒有方便的活性染色法,則可把膠體一片一片切下,做每一片膠體的活性測定。 |
|
| |
|
|
| |
儀器用具:
|
|
|
|
迷你電泳槽
(Hoefer Mighty Small SE
250)
|
|
|
|
鑄膠器
(Hoefer SE 245 可鑄造兩片迷你膠片)
|
|
|
|
鑄膠三明治組合:
(每一片膠片)
|
|
|
|
|
(1)
玻璃板
|
(8 × 10 cm)
|
小心易破裂
1 片
|
|
|
(2)
白色氧化鋁板
|
|
小心易破裂
1 片
|
|
|
(3)
Spacer 間隔條
|
(0.75 mm)
|
小心易遺失
2 條
|
|
|
(4)
Comb 樣本齒模
|
(0.75 mm)
|
小心易遺失
1 隻
|
|
|
|
|
電泳樣本專用微量吸管頭
(尖端較長且扁)
|
|
|
|
供電器
(可供應 200 V 電壓及 500 mA 電流者均可使用)
|
|
|
|
塑膠染色盒
(比膠片稍大且要能密蓋)
|
|
|
|
旋轉搖盪器
(rotary shaker)
|
|
|
|
看片箱
(light box)
|
|
|
|
護貝機及護貝膜
(可護貝如膠片大小者)
|
|
|
|
膠片乾燥組合:
|
|
|
|
(1)
玻璃板 (至少要比膠片大,約 12 × 15 cm,厚度約 3~4 mm)
|
|
|
|
(2)
玻璃紙 (Cellophane, 年糕紙,比上面玻璃板每邊多出 5
cm 以上)
|
|
|
|
以下聚丙烯醯胺膠體電泳所使用的試劑及方法乃根據
Laemmli (1970) 的方法。
|
|
| |
藥品試劑:
|
|
|
|
由於鑄膠溶液非常重要且多樣,因此下面把所有電泳溶液的配置方法仔細列出,希望能在每一個實驗室成功進行電泳;但使用者一定要明白其配製的原理與各種濃度的算法,而不是只會依配方泡製而已。
|
|
|
|
A
液: 丙烯醯胺液 (total 30%, cross-linking 2.6%)
|
|
|
|
|
丙烯醯胺 |
(acrylamide, Merck 10784) |
29.2 |
gm
|
|
Bis
架橋劑 |
(Sigma M-7256) |
0.8
|
gm
|
|
|
|
加純水溶解至
100 mL
|
|
u本步驟是 A
液也有商品已經配置好溶液者,本實驗課程採用 Ameresco
的 40% 溶液 (T40%, C2.6%),配法有些變動,請特別注意。 |
|
uBis 是
N',N'-methylene-bis(acrylamide) 的簡稱,可看成是兩分子
acrylamide 連在一起,作為架橋物,以便成為立體的膠體。 |
|
u以 30℃
加熱助溶,有不溶物質須過濾去除;若丙烯醯胺品質不佳或久貯,在溶成
100 mL 後,可加一些離子交換樹脂 Dowex MR-3
攪拌,放過夜並過濾後置 4℃ 保存。 |
|
u注意 acrylamide 溶液有
神經毒性!
不要直接接觸,凝膠後毒性消失,但膠體無法達到百分之百凝膠,因此也要小心處理膠片。 |
|
|
|
|
B
液: 分離膠體緩衝液 (running 或 separation buffer)
|
|
|
|
|
Tris
|
(Tris base, 1.5 M) |
90.8 |
gm
|
|
TEMED |
(Sigma
T-8133) |
1.8
|
mL
|
|
|
|
溶入
300 mL 水,以 l M HCl 119 mL 調 pH 到 8.8 再加水至 500
mL |
|
uTEMED (tetramethylenediamine)
可幫助自由基傳導,是催化劑。 |
|
|
|
|
C
液: 焦集膠體緩衝液 (stacking buffer)
|
|
|
|
|
Tris
|
(Tris base, 0.5 M) |
6.0 |
gm
|
|
TEMED |
(Sigma T-8133) |
0.4 |
mL
|
|
|
|
溶入
40 mL 水,加 l M HCl 47 mL 調 pH 至 6.8,加水至 100
mL
|
|
|
|
|
D
液: 電泳緩衝液 (chamber buffer),5× 溶液
|
|
|
|
|
Tris
|
(Tris base, 0.05 mM × 5) |
30.3 |
gm
|
|
甘胺酸 |
(glycine, 0.38 M
× 5) |
142.6 |
gm
|
|
|
|
溶入
800 mL 水,pH 調到 8.3 後再加水至 1 L。 使用時稀釋 5 倍。
|
|
u甘胺酸是電泳緩衝液的主要分子,是造成電泳樣本焦集的原因;近來多改用
boric acid (下面 F 液),應自行試用何者為佳。 |
|
|
|
|
E
液: SDS-PAGE 樣品溶液,2× 溶液
|
|
|
|
|
Tris
|
(Tris base, 125 mM × 2) |
3.0 |
gm
|
|
EDTA·2Na |
(2 mM
×
2) |
14.8
|
mg
|
|
SDS
|
(2%
× 2)
|
4.0
|
gm
|
|
b-mercaptoethanol |
(5%
× 2,
Sigma M-6250) |
10.0
|
mL
|
|
|
|
加水
80 mL 溶之,pH 調到
6.8,再加水至 100
mL |
|
|
|
|
F
液: 通用電泳緩衝液,5× 溶液
|
|
|
|
|
Tris
|
(Tris base, 90 mM × 5) |
54.5 |
gm
|
|
Boric
acid
|
(80 mM
× 5)
|
24.8
|
gm
|
|
EDTA·2Na |
(2.5 mM
× 5) |
4.7
|
gm
|
|
|
|
加水
800 mL 溶之,pH 調到
8.4,再加水至 1,000
mL
|
|
u使用時稀釋 5
倍。本溶液在 disc- 或 SDS-PAGE 均通用,後者要 加
SDS 至 0.1%。 |
|
|
|
|
SDS
水溶液 (10%)
|
|
|
|
|
uSDS
粉末很輕,揚起來很容易吸入肺部,在肺泡溶解產生界面活性的作用,使得肺部細胞無法進行氧分子交換,非常危險。 |
|
|
|
|
APS
溶液 (過硫酸銨, 5%):
|
|
|
|
|
APS
|
(ammonium persulfate, Bio-Rad 161-0700)
|
50
|
mg
|
|
|
|
溶於
l mL
水中,使用前才配製好,隔日不可再用。
|
|
uAPS 是自由基
(free radical) 的產生者,可誘發 acrylamide
的連鎖聚合反應,因此是整個凝膠反應的起始者。
|
|
u冬天可增至 10%,夏天可減至
2%。注意 APS 固體很容易分解,應密蓋貯於乾燥皿;鑄膠無法凝結的毛病,多出自
APS 的品質不良。 |
|
|
|
|
追蹤染料
(tracking dye):
|
|
|
|
|
Bromophenol
blue |
(Sigma B-6896)
|
l
|
mg
|
|
|
|
溶於
5 mL 水,再加 5 mL 甘油均勻混合。 |
|
u加在樣本蛋白質中,可增加樣本密度並賦予顏色,方便目視以注入膠片的樣本槽。
|
|
|
|
|
染色液
(CBR 染液):
|
|
|
|
|
Coomassie
brilliant blue R-250
|
(CBR, Sigma B-0149)
|
1 |
gm
|
|
|
|
溶於
250 mL 水後,再加入 250 mL 甲醇及
50 mL 醋酸混合均勻,充分溶解 CBR,若有不溶物質,則須過濾後裝瓶密蓋。
|
|
uCoomassie blue
有許多種不同的相關化合物,不要取用作為 蛋白質定量
用的 Coomassie blue G-250 來染色,效果稍差。
|
|
|
|
|
脫色液
(20% 甲醇及 10% 醋酸):
|
|
|
|
|
在一
1 L 量筒中,先倒入 200 mL 甲醇及
100 mL 醋酸,再加水至 1 L,混合均勻後密蓋備用。
|
|
u甲醇濃度可提高到 30%,則可增加脫色速度,但小心脫色過度。
|
|
|
|
|
|
|
|
|
標準分子量組合︰
|
|
|
|
Pharmacia
有高低兩種分子量的 標準蛋白質
組合,專供 SDS-PAGE
使用:
|
|
|
|
高分子量組:
Thyroglobulin (669kD, 330 kD), ferritin (440 kD, 220 kD, 18.5 kD),
catalase (232 kD, 36 kD), albumin (67 kD)
|
|
|
|
低分子量組:
Phosphorylase (94 kD), albumin (67 kD), ovalbumin (43 kD), carbonic
anhydrase (30 kD), trypsin inhibitor (20 kD), lactalbumin (14.4 kD)
|
|
|
|
另外
Novex 有預先染好藍色的 SeeBlue (LC5625)
標準蛋白質組合,除了一般電泳外,更可用在轉印,檢查轉印是否成功:
|
|
|
|
SeeBlue:
Myosin (250 kD), albumin (98 kD), glutamic dehydrogenase (64 kD), alcohol
dehydrogenase (50 kD), carbonic anhydrase (36 kD), myoglobin (30 kD),
lysozyme (16 kD), aprotinin (6 kD), insulin B chain (4 kD)
|
|
|
|
請注意:
SeeBlue 的分子量標度會隨著膠體濃度的不同而有所變化。
|
|
| |
方法步驟:
|
|
| |
SDS
平板膠片鑄造︰
|
|
| |
1)
整理出兩組玻璃片及白板鑄膠組合,先用酒精拭淨,並選擇合適的間隔條
(0.75 mm) 組合起來。
|
|
| |
u請熟悉鑄膠三明治組合的正確組裝方式,以免灌入的膠液漏出來。
|
|
| |
2)
三明治組合後直立站好,準備所要濃度的
SDS 膠體溶液如表 4.2。 兩片 0.75 mm 厚的平板膠片約需 10
mL 分離膠體溶液,以及 5 mL 焦集膠體溶液。APS
液到最後才加入,未加 APS 以前可在真空中抽去溶液中的氧氣。
|
|
|
T4.2
|
表
4.2 配製兩片
0.75
mm 膠片所需膠體
(mL)
|
|
| |
|
|
分
離
膠
體 |
焦集膠體 |
|
膠體百分比
|
5%
|
7.5%
|
10%
|
12.5%
|
15%
|
20%
|
1
0%
|
4%
|
4%
|
|
A
液
(40%)
|
-
|
-
|
-
|
-
|
-
|
-
|
5.0
|
-
|
0.5
|
|
A
液
(30%)
|
3.3
|
5.0
|
6.7
|
8
.3
|
10
|
13
|
-
|
0.66
|
-
|
|
B
液
|
5.0
|
5.0
|
5.0
|
5.0
|
5.0
|
5.0
|
5.0
|
-
|
-
|
|
C
液
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
1.24
|
1
.24
|
|
10% SDS
液
|
0.2
|
0.2
|
0.2
|
0.2
|
0.2
|
0.2
|
0.2
|
0.05
|
0.05
|
|
純水
|
11.4
|
9.7
|
8.0
|
6.4
|
4.7
|
1.7
|
9.7
|
2.95
|
3.11
|
|
APS 液
|
0.1
|
0.1
|
0.1
|
0.1
|
0
.1
|
0.1
|
0.1
|
0.1
|
0.1
|
|
總體積
|
20
|
20
|
20
|
20
|
20
|
20
|
20
|
5
|
5
|
|
|
| |
u上表粉紅色部份為使用 40% A
液製備的配方。
|
|
| |
|
|
| |
3)
以上分離膠體各成份在小燒杯中混合均勻後,可直接沿著玻璃一側倒入鑄膠組合到預定高度
(約八成高),勿陷住氣泡;再輕輕加上一層 isopropanol。
也可使用滴管慢慢加入膠體,同樣勿注入氣泡。
|
|
| |
4)
約 30 min 可凝結,以濾紙吸去 isopropanol,同法倒入焦集膠體溶液,要加到滿;儘快
插入樣品槽齒模,注意不可有氣泡陷在膠體中。
|
|
| |
u一般在凝膠完成後,膠體與所加的水層之間,會出現清楚的直線界面,但因為背景為白色,較不易觀察之。
|
|
| |
5)
再度凝結後取下齒模即可使用。若不立刻使用,則把整個膠片組合用保鮮膜包好,膠面上方加一水層,勿使乾掉,在
4℃ 約可放 1~2 週。
|
|
| |
電泳方法︰
|
|
| |
6)
若膠片組合保存於 4℃,則要等待膠片完全回復室溫,才架到電泳槽。
|
|
| |
u膠片一定要完全回溫,否則在進行電泳時,玻璃會因熱脹而破裂。
|
|
| |
7)
取 F 液稀釋成一倍溶液,並加 SDS 成為 0.1%;先倒入下方的正極槽,注意不可有氣泡黏在膠體,然後倒入上方的負極槽。用微量針筒或微量吸管一個一個清洗樣本槽,除去殘留在槽內的膠體
(刷牙)。
|
|
| |
u刷牙的動作很重要,而且要徹底,否則注入樣本時,會有大麻煩。又因為白色氧化鋁板乃白色背景,不容易看出樣本槽的位置,可用
Hoefer
所附的透明樣本槽位置模板,作為指引,順便可練習樣本添加的動作。
|
|
| |
8)
取蛋白質樣本溶液,加入同體積 E
液,以及適量追蹤染料 bromophenol blue,混勻後在 100℃
加熱 10 min。放冷短暫離心後即可依次以微量吸管注入樣本槽,樣本體積可自斟酌,但要記好位置及體積;通常都使用
5~15 mL。
|
|
| |
u注入樣本時,儘量把針頭或吸管伸到樣本槽底部,但不要觸到樣本槽底的膠面,則可以使得
樣本所佔的體積最小,分離效果較好。
|
|
| |
9)
裝上電源蓋,以 100~150V 進行電泳,最高可加至 200V,視實驗的緊急程度,以及膠片發熱的情形而定。通電後兩極附近會立刻產生無數細微氣泡,是通電的特徵。
|
|
| |
10)
追蹤染料很快進入膠體,開始焦集成藍色細線,並向下泳動,大約
1 h 可泳動到底邊,中止電泳,除去電源蓋。
|
|
| |
u有些
分子量較大 的樣本,或使用濃度較高的膠片,可以等到藍色細線泳出膠體才停止。
|
|
| |
膠片染色法:
|
|
| |
11)
取出膠片組合,使玻璃板向上,先除去兩側間隔條,再以扁形藥匙輕輕撬起玻璃,膠片則留在白板上。切除焦集膠體,並在分離膠片的右上方截角做記號
(區別膠片的左右)。
|
|
| |
12)
取染色盤 (大約比膠片稍大),倒入 CBR
染色液,在染色盤上方把上述白板倒翻過來,挑起膠片一角,利用重力使膠片掉落到染色缸中。
|
|
| |
u若要進行蛋白質轉印,則膠片不能染色,要浸入轉印緩衝液中。
|
|
| |
13)
在 CBR 中染色約 30 min,染色盤要加密蓋,置於旋轉平台慢速
50 rpm
搖盪之;要注意膠片是否完全沒入染色液中,否則會造成染色不均勻。
|
|
| |
14)
染色後小心把 CBR
染劑倒回原來瓶中,整塊膠片變成藍色,先用自來水洗掉殘餘的染色液,再倒入約
20 mL
脫色液,加密蓋後再放回旋轉平台搖盪。染色脫色過程請戴手套,否則會在膠片上留下指紋。
|
|
| |
15)
膠片的藍色背景漸漸脫掉,待脫色液轉成藍色後,可以換新脫色液;如此脫色數次,在一小時內應可看到蛋白質的藍色色帶出現。用過的脫色液,請回收倒在有機溶液的廢液桶中。
|
|
| |
16)
待膠片背景完全透明後,染色脫色完成。倒去脫色液,改用
50%
甲醇液洗一兩次,待膠片縮至大約原來的尺寸,則可準備乾燥之。
|
|
| |
膠片乾燥法:
|
|
| |
17)
把玻璃紙 cellophane
先用水浸溼,平鋪在乾燥用的玻璃片上,玻璃紙會比玻璃片大,因此四週有多出來的部份。
|
|
| |
18)
把膠片平鋪在玻璃紙中央,膠片與玻璃紙間不要有任何氣泡。
|
|
| |
u除了氣泡之外,若膠片沒有回復原來的大小,或者膠片的四邊有傷痕,都很容易造成膠片乾燥後的龜裂現象。
|
|
| |
19)
在膠片上再加一層浸溼的玻璃紙,也不要陷有氣泡在內;把玻璃紙多出來的部份反摺到玻璃背面,用手抹平表面水份,並用紙巾吸乾。
|
|
| |
20)
把此乾片三明治組合放在桌上,次日即可得到已經乾燥好的膠片,用電風扇或冷氣機吹之,可以加快乾片速度。
|
|
| |
u有乾片後用指甲尖輕敲膠片,若還可以看到指甲所留下的痕跡,表示膠片並未完全乾燥,要再等候。
|
|
| |
21)
待膠片完全乾燥後,以美工刀或剪刀去除多餘的玻璃紙,再加以護貝,則可永久保存之。免疫染色的轉印紙,也可以護貝保存。
|
▲
|
| |
|
|
|
4.2.4 |
蛋白質轉印法 |
|
| |
|
|
| |
蛋白質經
SDS-PAGE 後,膠片浸入轉印緩衝液,蛋白質可被 轉印
到硝化纖維紙
(nitrocellulose) 上,先經尿素洗去 SDS,並使蛋白質回復原態抗原性,可使用抗體進行
免疫染色
(Towbin et al, 1979)。 |
|
| |
|
|
| |
儀器用具:
|
|
|
|
電泳轉印槽
(Hoefer Transphor TE
52):
|
|
|
|
轉印槽
(可容納 4 個轉印三明治)
|
|
|
|
轉印三明治
(轉印夾、方形海綿墊 2 片)
|
|
|
|
轉印紙:早期使用硝化纖維紙,現在多用尼龍材質者
|
|
|
|
Immobilon-P
(Millipore IPUH 000 10, 0.45 mm,
PVDF 材質)
|
|
|
|
濾紙
(Whatman #1, 3MM) 兩張,裁成比轉印紙稍大者。
|
|
|
|
供電器
(可供 400~500 mA 者)
|
|
|
|
方形培養皿
(轉印紙清洗用)
|
|
|
|
旋轉搖盪器
(rotary shaker)
|
|
| |
藥品試劑:
|
|
|
|
轉印緩衝液
(Blotting buffer): 10×溶液
|
|
| |
|
Tris
|
(Tris base, 25 mM×10)
|
60.6
|
gm
|
|
甘胺酸
|
(0.192 M×10)
|
288.0
|
gm
|
|
|
|
加水
1,500 mL 溶之,pH
以 HCl
調到 8.3,加水至 2,000
mL |
|
u使用時取 500 mL
倒入一 5 L 桶中,加 500 mL 甲醇後,加水到 5 L,均勻攪拌之。
如此配成者,含 10%
甲醇;若是轉印胜汰或是蛋白質的分子量太小,可提高到
20%。
|
|
|
| |
甲醇
(用來潤溼尼龍材質的轉印紙)
|
|
| |
PBST
洗液:
|
|
| |
PBST
為 pH 7.0 的 PBS (phosphate buffered saline) 緩衝液,另加有 0.05%
Tween-20,用來清洗轉印紙,以去除非專一性的蛋白質吸附。
|
|
| |
尿素洗液
(6 M Urea-PBST) :
|
|
| |
尿素
180 gm 溶在 300 mL PBST 中,加溫攪拌溶解,再加 PBST 至 500
mL。
|
|
| |
|
|
| |
方法步驟:
|
|
| |
u全程請
戴手套操作,以免污染轉印紙!
|
|
| |
1)
電泳後 SDS-PAGE 膠片浸在轉印緩衝液中,洗 2~3
次,每次 10 min。
|
|
| |
2)
取出轉印槽,先小心放一攪拌子在底部,再倒一半轉印緩衝液。
|
|
| |
u攪拌子千萬不能丟到轉印槽內,會打破轉印槽底部的陶瓷散熱片。
|
|
| |
3)
取轉印紙切成約如膠片大小,先在方形培養皿中以少許甲醇浸溼數秒鐘,再置入轉印槽中的緩衝液
10 min 後使用。
另取兩張濾紙,以及兩片方形海綿墊,都放在轉印槽的緩衝液中備用。
|
|
| |
4)
取出轉印夾打開平放,先墊一張方形海棉墊,舖上一張溼濾紙,小心疊上已潤溼的轉印紙,其間
勿陷入氣泡;轉印紙再滴上數滴緩衝液後,小心平舖膠片上去,加蓋一層濾紙,及另一張海綿,也都不可陷入氣泡,即可把整個轉印三明治卡夾裝好。
|
|
|
|
u膠片疊到轉印紙時,最好一次成功,不要重作,否則蛋白質色帶可能會印上去,最後產生重疊影像。
|
|
|
|
5)
將轉印三明治置入已經放有一半轉印緩衝液的轉印槽中,注意有
轉印紙的那一面向正極
(紅色),膠片那面向負極
(黑色)。
|
|
| |
6)
當三明治都放入轉印槽後,以轉印緩衝液蓋滿所有的三明治,小心動一動卡夾,除去附在卡夾內外的氣泡,蓋上蓋子,放到一攪拌器上,打開攪拌器開始攪拌,同時接好電源,裝置完成後放置
10 min。
|
|
| |
7)
以 400 mA 開始轉印,溫度會漸漸上升,轉印 1.5
h 後中止轉印,取出轉印三明治,打開後依次取出轉印紙及膠片。
|
|
| |
u上述轉印條件會使溫度上升至
70~90℃,若有冷卻系統,可把溫度控制設在 5℃;轉印槽內應該加以攪拌,以便使整個溫度分佈均勻。
|
|
|
|
8)
轉印後的膠片可以繼續進行 CBR
染色,看有無蛋白質殘留。
若電泳時加有藍色標準蛋白質 marker (SeeBlue),則 可在轉印紙上看到藍色的色帶,確定轉印成功,並可評估轉印效率。
|
|
|
|
9)
轉印紙浸在約 15 mL
尿素洗液中浸洗過夜,期間換三次尿素洗液,並且要溫和搖盪之。
|
|
| |
10)
若不做免疫染色,則轉印後不用尿素洗液清洗,以清水沖過後改用
amido black (l % 溶於 10% 甲酸) 染色 1
h,再以 10% 甲酸脫色,沖水後晾乾即可,但其 靈敏度較低。
|
|
| |
註解討論: |
|
|
|
a.
轉印時槽內的水溫並不均勻,液面的溫度比底部要高,電流也就不會均勻,注意轉印效果因此會有差異;最好加以攪拌使水溫均勻。
|
|
|
|
b.
膠片及轉印紙應切角做記號,以分辨左右或正反面,免得呈色後分不清樣本的次序。
|
|
|
|
c.
甲醇可提高到 20%,一般 分子量越小,所用甲醇的含量越高;但甲醇含量太高,可能會使分子量太大者不易泳離膠體。
|
|
| |
■
結果參考『概說』Slide
8
|
▲
|
| |
|
|
|
4.2.5 |
免疫染色法 |
|
| |
|
|
| |
轉印到紙上的蛋白質抗原,可與其專一性抗體結合,再以
二次抗體-酵素結合體 (2nd Ab-HRP) 或
Protein A-HRP
呈色;可在一群轉印色帶中,專一性地挑出目標蛋白質,是最有用的檢定工具
(Burnett, 1981)。 |
|
| |
|
|
| |
藥品試劑:
|
|
|
|
抗體溶液:
可用傳統抗血清或單株抗體,其最適使用濃度,隨抗體效價不同而異,以下為一般適用範圍的參考,均以
明膠-NET 稀釋之。
|
|
|
|
a.
傳統抗血清: 1:100 到 1:1,000
|
|
|
|
b.
IgG (冷凍乾燥品): 10~50 mg/mL
|
|
|
|
c.
單株抗體 (小白鼠腹水): 1:200 到
1:5,000
|
|
|
|
d.
單株抗體 (細胞培養液): 原液或
1:10
|
|
|
|
明膠-NET:
用來稀釋抗體溶液或酵素連結體
|
|
| |
|
明膠
gelatin
|
(Merck 4070, 0.25%)
|
5.0
|
gm
|
|
NaCl
|
(0.15 M)
|
17.5
|
gm
|
|
EDTA |
(5 mM) |
3.6 |
gm
|
|
Tween-20
|
(0.05%)
|
1.0
|
mL
|
|
Tris |
(Tris base, 50 mM) |
12.1 |
gm
|
|
|
|
加熱溶解於
1,800 mL 純水後 pH
調到 8.0,再加水到 2,000 mL |
|
|
| |
酵素連結體:
|
|
| |
可使用
2nd Ab-HRP 或 Protein A-HRP,使用濃度每家商品不同,約為
1:1,000 到 1:5,000 之間,以 明膠-NET 稀釋之。
|
|
| |
PBST
洗液
|
|
| |
DAB
基質溶液:
|
|
| |
|
DAB |
(diaminobenzidine, Sigma
D-5637) |
5 |
mg
|
|
|
|
溶於
100 mL Buffer A-0,再加 10 mL
H2O2,新鮮配製,避光貯存。
|
|
uDAB 為致癌物質,稱量時勿吸入 DAB
細塵,並小心處理秤量紙。 |
|
|
| |
方法步驟:
|
|
| |
1)
尿素洗過夜的轉印紙再以 10 mL PBST 洗三次,每次約 10 min,均在上述方形培養皿中進行。
|
|
| |
2)
轉印紙放在 明膠-NET 溶液中反應,置室溫中反應 1 h。一般使用方形培養皿當容器,但亦可裝入塑膠袋中反應,較節省試劑用量。
|
|
| |
3)
反應後,以 PBST 浸洗二次。
|
|
| |
4)
把轉印紙放在抗體溶液中反應,置室溫反應 1 h。
|
|
| |
5)
反應後以 PBST
洗三次,改用酵素連結體反應,在室溫下反應 1 h。
|
|
| |
6)
以 PBST 洗四至五次,注意 容器也要洗乾淨。
|
|
| |
7)
加入 DAB 基質溶液約 10 mL
呈色,儘量避光,並且不時搖動呈色液。
|
|
| |
8)
數分鐘內可呈色,在背景加深前倒去 DAB,以水沖過數次後晾乾。
|
|
| |
註解討論: |
|
|
|
a.
非專一性的呈色經常會造成困擾,此問題可用尿素洗液解決,尿素可洗去
SDS,且使蛋白質或胜汰回復其構形或抗原性。
|
|
|
|
b.
DAB 呈色時,應含有一不會呈色之 負對照組
作為比較;
當樣本含有標準分子量的組合時,其蛋白質色帶應不會呈色。
|
|
| |
■
結果參考『概說』Slide
8
|
▲
|
| |
|
|