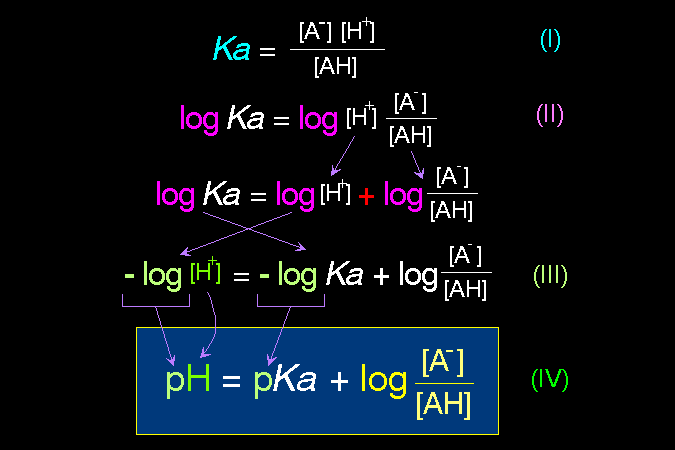第二章 胺基酸
除了水之外,在生化課裡第一個碰到的重要生物分子,就是胺基酸。 這一章將說明胺基酸的構造與性質,看它長麼樣子,做什麼用途。 事實上,所有的生化分子,都可分成構造與性質兩方面來說明,同學們若能把握此二重點,往後的生物化學課程必可順利學習好。
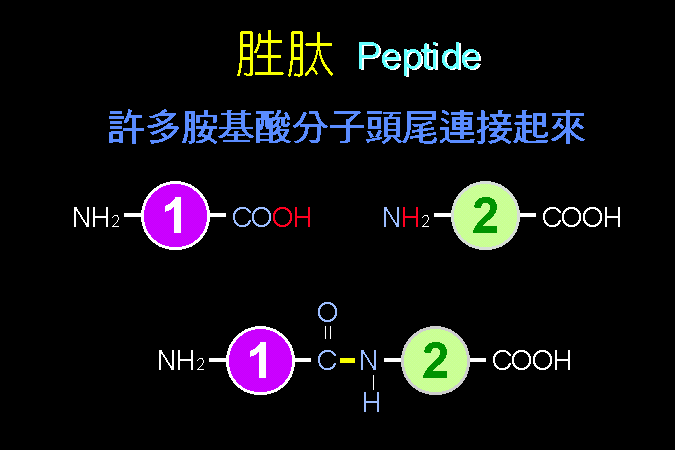
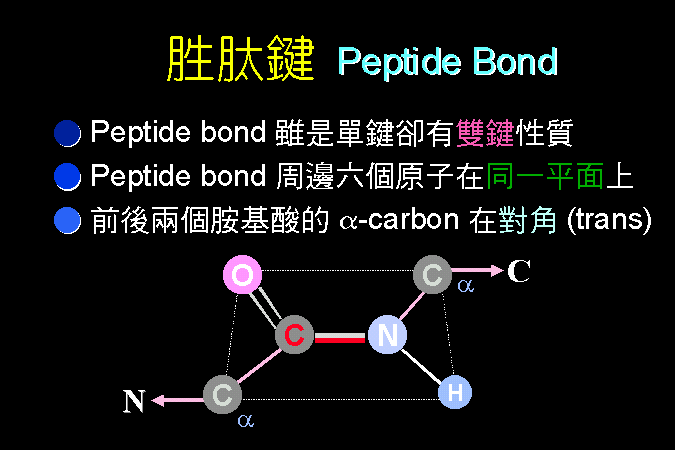
胺基酸雖然有二十種,但其基本構造骨架是相似的 (第一節);我們將描述這些生物體內常見胺基酸的構造 (第二節),並且分類說明其側鏈基團的極性或非極性特質;我設計了一張模擬的地下鐵地圖 (圖 2),用來說明各種胺基酸之間的構造關係,並且方便記憶;但請注意此圖並非代謝途徑。 然後看兩個胺基酸間如何連接成胜肽 (第三節),很多這樣的胜肽已經具有生理功能。
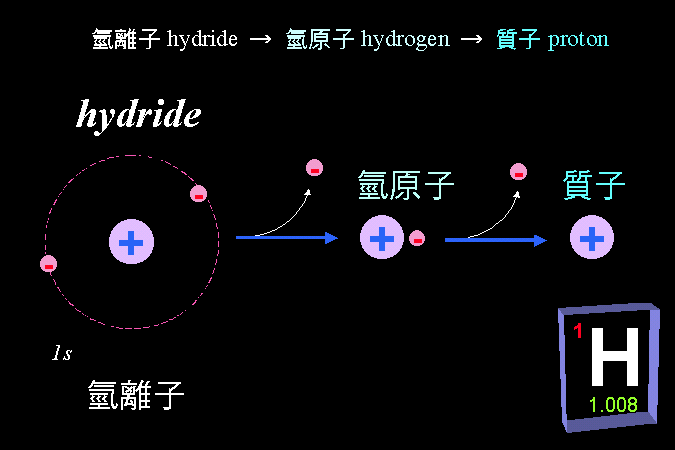
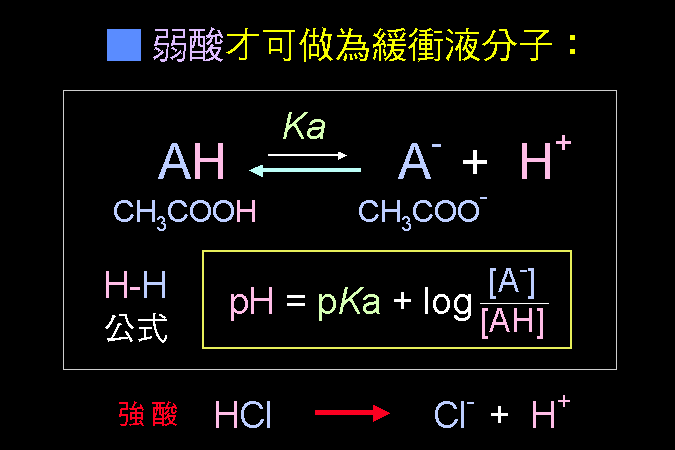
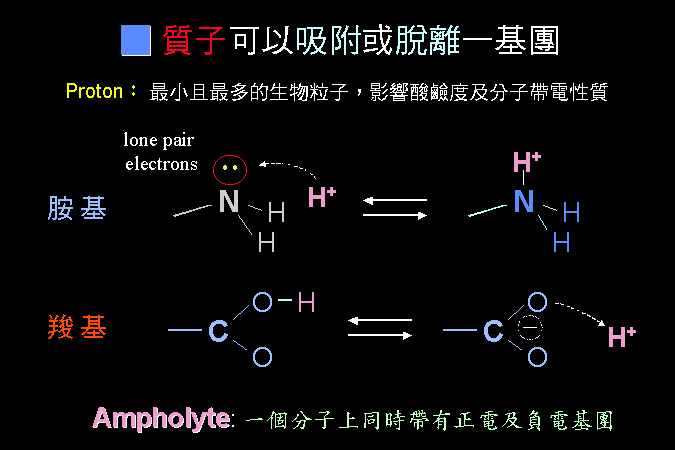
最後 (第四節) 說明胺基酸最重要的性質,即其很容易離子化的特性:同一個胺基酸分子上,同時帶有正電及負電;當這些胺基酸組合成蛋白質時,這種離子性質也延續到蛋白質上,造就了蛋白質的離子特性,賦予蛋白質應有的構形與活性。 這是學習生物化學成敗的第一個關卡,請一定要痛下決心整理清楚,否則以後的觀念都不會正確。
■ 到講義相關部份