| 1 |
下面各記錄中,紫色文字為指導教師的建議或意見;橘紅色文字為總結。 |
| 2 |
優先只列出第一優先者,標以 1;並以 * 代表要特別小心的陷阱。 |
| 3 |
報告時先要把你的 實驗流程 檢討一次,且每次都要回顧上次的流程與記錄。 |
| 4 |
報告時一定要請同學幫你記下討論過程的問答,以便整理出下面 (D) 的答問錄。 |
| 5 |
後續整理請交出 (R) 以條列方式列出報告的各項成果 (D) 條列討論過程的答問錄。 |
| 6 |
請儘量在報告的 當週週末 完成上面 (5) 後續整理,貼到 Meeting Room 520-2 上。 |
|
暑假中進度報告將暫停,請努力累積結果開學將馬上驗收成果。 |
|
|
記 錄 事 項 | 優先 |
|
上次報告 < 6 > Final |
|
|
| R1 |
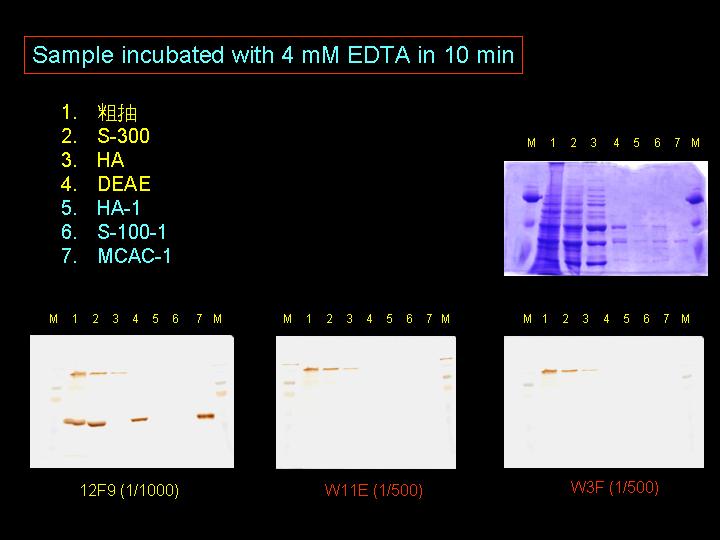
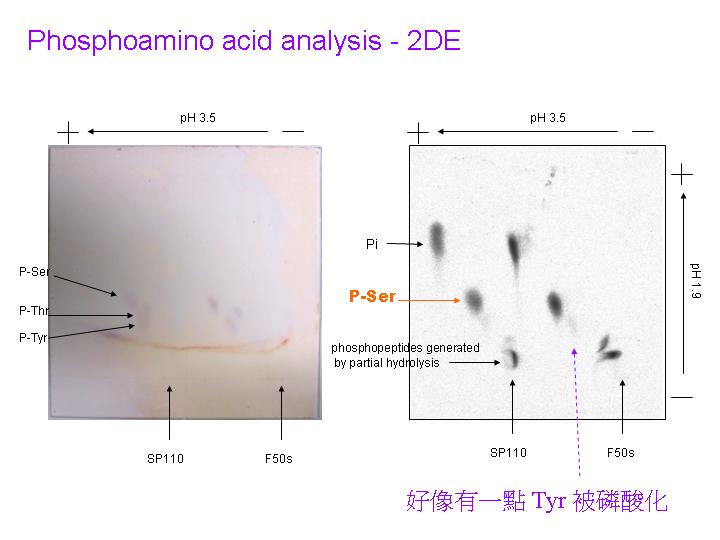
使用三種抗體對 2DE 轉印膜呈色,標定 PCS 可能位置,將色點進行胺基酸定序。 |
|
| R2 |
N-端定序結果大部分色點均為 N-端 blocked,只有兩個色點定出序列,其中之一點與阿拉伯芥假設的 PCS 有高相似度。 |
|
| R3 |
另送 LC-MS/MS 結果由於操作人員失誤,因此無實驗結果。 |
|
| R4 |
SDS-PAGE 中的 110 kD 色帶應為 A + B 呈色系統所造成的非專一性呈色。 |
|
| R5 |
改由 2DE 方式的 TCA 樣本處理,原先 PCS 在 2DE 的 110 kD 處不會被抗體偵測到,但是在 1DE 的 SDS-PAGE 中,110 kD 處卻仍有非專一性呈色。 |
|
|
|
||
| D1 |
可能要以不同的轉印膜,分別對各抗體呈色,以確定所抓到的色點是否為同一點。 |
|
| D2 |
抗體專一性仍相當存疑,在 2DE 利用不同抗體呈色以尋找 PCS 的方法需再確認。 |
* |
| D3 |
在 2DE 負極緩衝液添加 thioglyco acid (?),可降低蛋白質在電泳過程 N-端被 blocked。 |
* |
| D4 |
以不同方式處理 PCS,在免疫呈色的結果也不同,其原因不單純,可能不只是金屬離子對蛋白質構形的影響所造成。 |
|
| D5 |
抗體對 PCS 活性影響的實驗,需再嚴謹設計,進行確認。 |
|
| D6 |
LC-MS/MS 的定序仍需持續進行。 |
|
|
|
||
| ★ |
雖然 2DE 中有一點是 PCS 的片段,但整個 2DE 的結果仍然不很清楚。 |
|
|
三種抗體中看來還是 12F9 最強,也許可做成親和管柱去抓 PCS 來定序。 |
|
|
| 以上各項工作結果請於下次報告中提出檢討 | ||
▲ TOP ▲
|
|
記 錄 事 項 | 優先 |
|
上次報告 < 6 > Final |
|
|
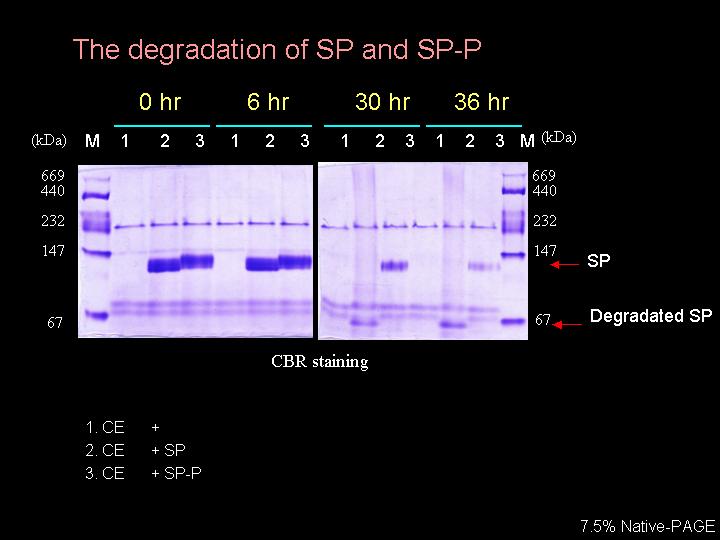
| R1 |
以連續層析步驟純化出的磷酸脢,對 L-SP 無法有去磷酸作用。 |
|
|
|
||
| D1 |
確定甘藷塊根中有無 L-SP 專一性之磷酸脢,可使用粗抽液與 total protein (0-90%) 分別測試,要同時加入 protease inhibitor 及 proteasome inhibitor。 |
1 |
| D2 |
另試以 45C 處理甘藷切片,觀察加熱能否誘導產生 L-SP 的專一性磷酸脢活性。 |
1 |
| D3 |
純化表及活性染色都要加 SDS-PAGE 結果,與 disc-PAGE 作為對照。 |
* |
|
|
||
| ★ |
重作純化過程的 disc-PAGE,並加重樣本量 (>10 mg/well),看是否有 L-SP 磷酸脢。 |
|
|
最低限度是證實目前的組織與條件,並沒有 L-SP 的專一性磷酸脢,但有其他者。 |
|
|
| 以上各項工作結果請於下次報告中提出檢討 | ||
▲ TOP ▲
|
|
記 錄 事 項 | 優先 |
|
上次報告 < 6 > Final |
|
|
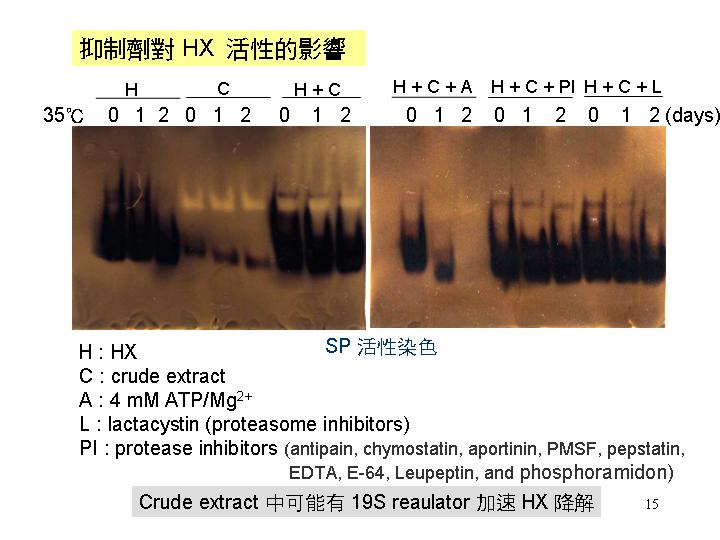
| R1 |
Crude extract 中可能有 19S proteasome regulator 可加速 HX 降解。 (此結論待查) |
? |
| R2 |
SDS 造成 HX 的泳動率變快,可能是因為致使 proteasome 的活性變強。 |
|
| R3 |
在 pH 10 時,HX 的泳動率變快,可能是因為 proteasome 的活性變高降解 SP。 |
|
| R4 |
Double staining 的結果顯示,SP 和 proteasome 可能互相結合。 |
|
|
|
||
| D1 |
論文中的名詞請使用專業術語,整體文字必須簡潔而中肯 (moderate)。 |
|
| D2 |
各梯次的 double diffusion 結果好壞互見,收集比較好的幾張放在一起比較。 |
|
| D3 |
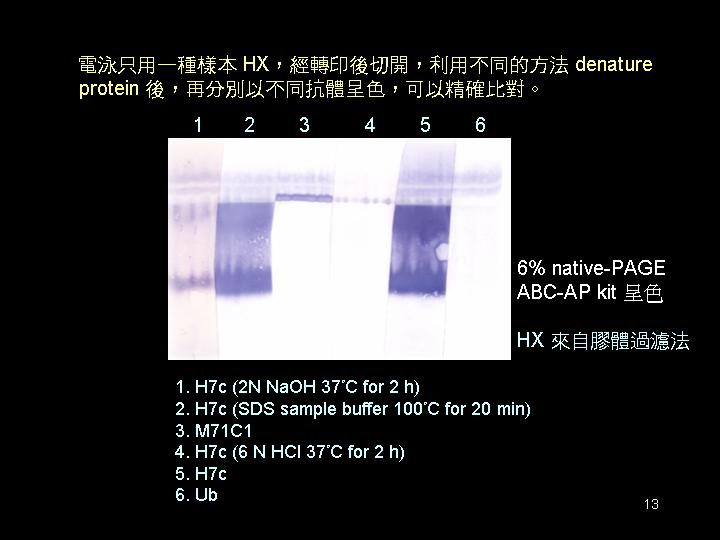
HX 經各種變性處理之 Western blotting 檢定,需重新找好條件再試,看是否含 L-SP。 |
1 |
| D4 |
每天取一點 4℃ 中的 HX 放置於 -20℃中急凍,一起觀察 HX 貯存過程的活性變化。 |
1 |
| D5 |
HX 活性變化實驗,要以 SP only 作為 control,並確定 sample 中的 pH 值。 |
|
| D6 |
Proteasome inhibitors (lactacystin) 和 ATP 對 HX 活性影響實驗要重做。 |
* |
| D7 |
HgCl2 的抑制時間必須相同,電泳可跑久一點,使 HX 位於膠片中間。 |
|
| D8 |
查出 ATP 是抑制還是促進 proteasome 的活性。 |
|
| D9 |
找出可用的 anti-proteasome mAb。 |
|
| D10 |
重複螢光染色的問題,需找出方法解決,可向 513 借用螢光顯微鏡。 |
|
| D11 |
Double staining 用連續切片單獨染色即可,另外需加 AP 呈色作為 control。 |
1 |
|
|
||
| ★ |
把已有的結果整理好 (如雙向擴散),然後儘量把未完成的工作作好 (如組織染色)。 |
|
|
Lactacystin 好像無法抑制 HX 降解,反而 protease inhibitor 可以,。 |
|
|
| 以上各項工作結果請於下次報告中提出檢討 | ||
▲ TOP ▲
|
|
記 錄 事 項 | 優先 |
|
上次報告 < 3 > 下次報告 |
|
|
| R1 |
17 cm 的 2DE 圖譜與小的 2DE 圖譜 相當不同,要重新建立標準流程。 |
|
| R2 |
六個色點開始定序,LC/MS/MS 比 N-端定序靈敏精準,所得序列還湊不出相關性。 |
|
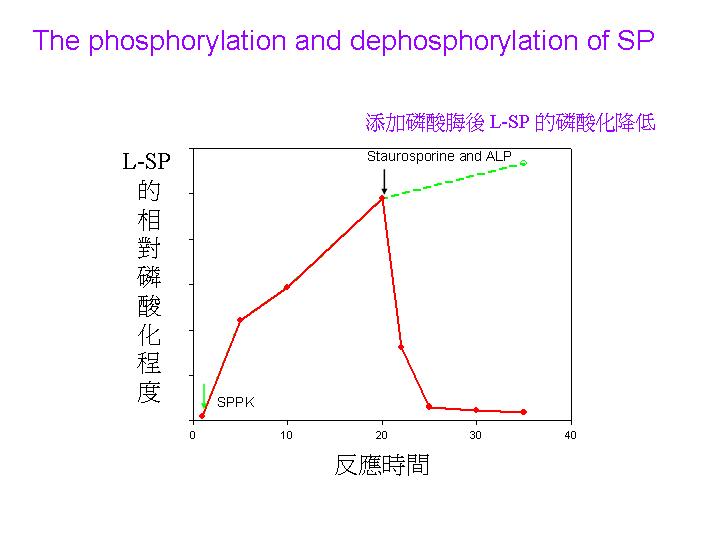
| R3 |
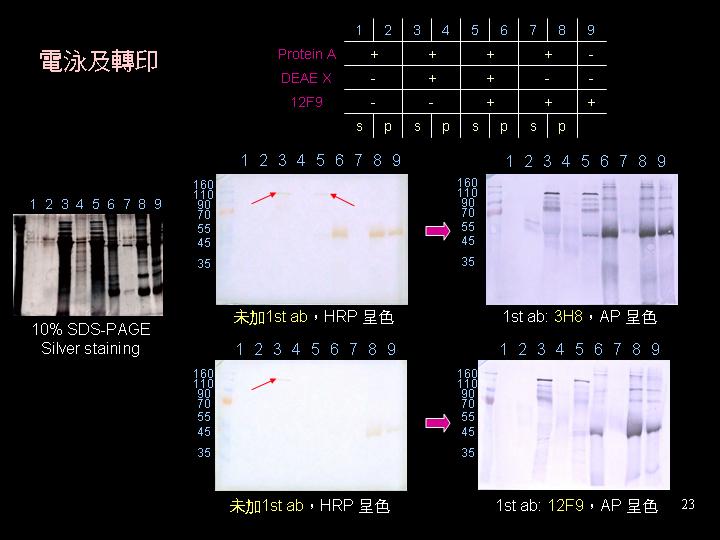
蛋白質體免疫過程已經三個月,抗體的組成確實會有消長情形 (見上圖)。 |
|
| R4 |
抗體庫已進行第一次融合,1DE 免疫篩選器可用,建議提高抗原量以篩出低量者。 |
|
|
|
||
| D1 |
繼續對 17 cm 的 2DE 確立流程,以建立 2D 標準圖譜,才能開始下游工作。 |
|
| D2 |
然後以分析軟體比對出有變化的蛋白質,進行 N-端定序或 LC/MS/MS,確定身分。 |
|
| D3 |
抗體庫工作繼續進行,需要大量人力,請新生多多參與,也要找到能幹的助理。 |
|
| D4 |
試進行非水溶性竹筍蛋白質的免疫,並確立非水溶性蛋白質的 2DE 圖譜。 |
|
|
|
||
| ★ |
確定 17 cm 的整個流程,然後再去進行原計畫所預定的目標。 |
|
|
抗體庫先以未出土為對象,大體先進行過一次很重要,然後再一邊改進。 |
|
|
| 以上各項工作結果請於下次報告中提出檢討 | ||
▲ TOP ▲
|
|
記 錄 事 項 | 優先 |
|
上次報告 < 博士班資格考試 > 下次報告 |
|
|
|
|
||
|
張老師: |
||
| 1 |
PCS 純化過程應完整列在論文中,包括純化表等,便於讓大家迅速瞭解整個流程。 |
|
| 2 |
如何確定圖 3.12 中的 peak 即是 PC2? 又如何證明 GSH 與 GSSG peaks? |
|
|
重複收集 peak 後進行酸水解,再進行胺基酸組成分析。 發現 Glu/Gly 比值約為 2,可確定為 PC2。因 Cys 會形成氧化態,故不以 Cys 來比較。 GSH 與 GSSG peak 可只跑標準品來確定。 |
||
| 3 |
圖 3.10 規律變化的 peaks 在 multiple charge 的圖譜中相當少見,有可能是配位化合物所造成,也有可能鎘已不見,可利用 tandem MS 來分析每根 peak 組成。 |
* |
| 4 |
題目中的『重金屬』應去掉,只稱呼『鎘』即可。 |
|
|
|
||
|
陳老師: |
||
| 1 |
本實驗室之前也曾研究過這個酵素,遇到一個問題,在經 HPLC 純化後為單一 peak,但是經電泳後卻發現此蛋白質似乎會黏在一起,因而出現多條 bands。有可能是因為含 Cys 較多的蛋白質會出現這種現象,所以在進行實驗前應先還原雙硫鍵。 |
* |
| 2 |
關於金屬光澤是否為含硫化合物,或是屬於配位化合物,這些都是屬於無機化學方面問題,化學系有開相關課程,若要繼續從事這方面研究,應該加強相關背景知識。 |
|
| 3 |
有無想利用表現方式來研究 PCS? |
|
|
PCS 的表現已有許多研究團隊做過,但純化方面卻很少,因此從事這方面研究較具特色及競爭力,而且純化所得蛋白質其功能性質也較符合 in vivo 狀態。 |
||
| 4 | 『二次元電泳』請改為『二維電泳』較為恰當。 | |
| 5 |
如何從你的二維電泳來定義 PCS ? |
|
|
利用單株抗體所進行之 Western blot 只抓到幾個蛋白質色帶,可針對這幾點加以定序分析,當然也可進一步純化後再進行二維電泳。 |
||
|
|
||
|
楊老師: |
||
| 1 |
目前已推斷出 PCS 序列,請問有沒有人將其表現出來?應隨時 review PCS 文章,知道目前進度為何。 |
|
|
已知有人將阿拉伯芥的 PCS 基因表現在 E. coli 中,的確可以加強 E. coli 對鎘的耐受性。 |
||
| 2 |
有人發表 PCS 就是 glutathione synthetase,而且最近也在線蟲中發現 PCS gene,你認為 PCS 的作用是演化上的壓力或是適應環境的結果? |
* |
|
PCS 就是 glutathione synthetase 這個我倒是沒注意到,不過一般認為 PC 合成途徑應如 圖 1.1 所示。演化需要時間考驗,重金屬污染也不過是近幾世紀才越來越嚴重,而且 PC 的作用也不只是與重金屬結合而已,另外還有平衡金屬離子濃度及抗氧化的作用,因此 PCS 有可能因應環境變化來作用。 |
||
| 3 |
多 review 前人 papers,對 PCS 之其它作用也應詳加介紹。 |
|
|
|
||
|
李老師: |
||
| 1 |
你的實驗都是延續之前學長所作的題目,比較吃虧是較沒有自己的方向,今後應強調自己所研究新的部份。 |
|
| 2 |
兩個研究題目範圍都很大,選擇其中之一進行即可,若要選擇,請問你會選擇那一個題目進行? |
* |
|
我會選擇 PCS 的題目進行,因為這個方向較為明確。H6 是個新發現,雖然目前還不能確定其組成,但是潛力無限。若有時間的話,這方面我仍會繼續研究。 |
||
| 3 |
論文上仍有些小缺點要注意,屬名第一次出現應標示全名。題目訂定似乎不太恰當,可以等到實驗累積一定成果時再來定題目。 |
|
| 4 |
不管是從蛋白質方面或是分生方面著手,都應注意其優缺點,這就是我考你第三題的目的,可以的話應兩者並重,對實驗思考會有很大幫助。 |
|
|
|
||
|
研究報告討論: |
||
| D1 |
HPLC 色析圖譜應該加上座標軸以利判讀。 |
|
| D2 |
題目寫法有待商榷,等到實驗進行一定成果時,再予確定。 |
|
| D3 |
強調自己所做之 PCS 單株抗體與別種抗體的差異,並討論色帶專一性不同的原因。 |
|
| D4 |
以本實驗室之 PCS 研究大綱為藍圖,畫出本論文的研究範圍及目標。 |
|
| D5 |
最後應加上一張未來研究方向之詳細計畫表,作為將來的研究主軸。 |
* |
|
|
||
| ★ |
未來將專注在 PCS 方面的酵素學研究,先把純化、抗體、基質等工具建立好。 |
|
|
確定的成果較少,研究要更有效率,在困難發生時,抓對要點,解決問題。 |
|
|
| 以上各項工作結果請於下次報告中提出檢討 | ||
▲ TOP ▲

.jpg)
.jpg)

.jpg)
-wyj.jpg)