|
|
記 錄 事 項 | 優先 |
|
Slide 位置: 520-1 > D > 2483 > Meeting Room > [LSP021225.ppt] 要密碼 |
|
|
| R1 |
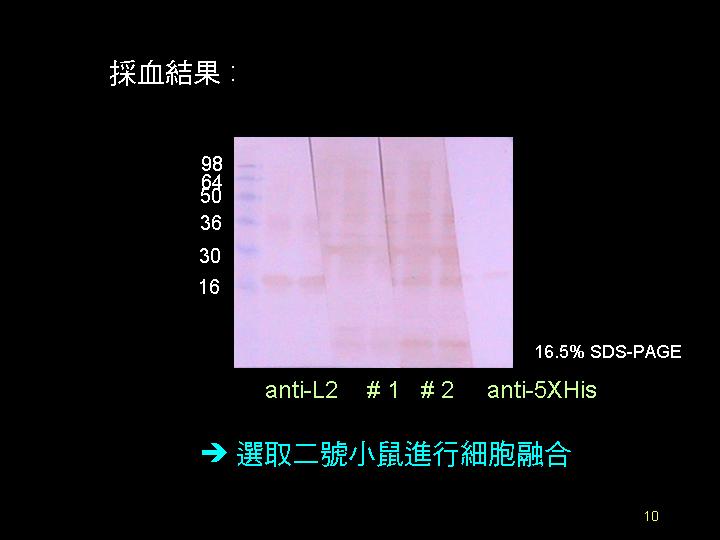
還是要先把握住 L100 的抗體,有抗體後就能做一些磷酸化的探討。 |
1 |
|
L78+ 還是改成 L100 比較容易辨別。 |
||
| R2 |
另外,L100 的表現與純化步驟,可以再加修正,以求穩定的 L100 來源。 |
1 |
| R3 |
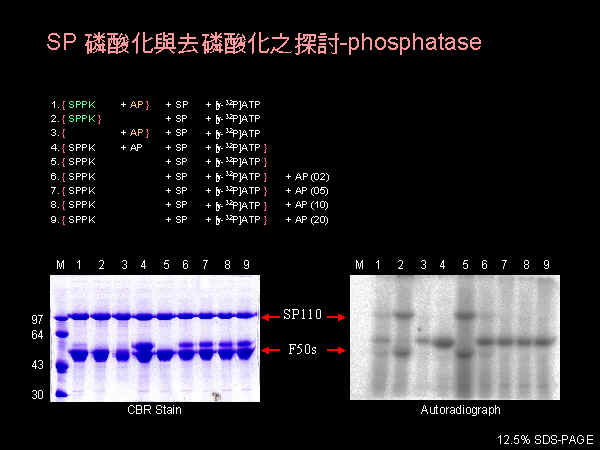
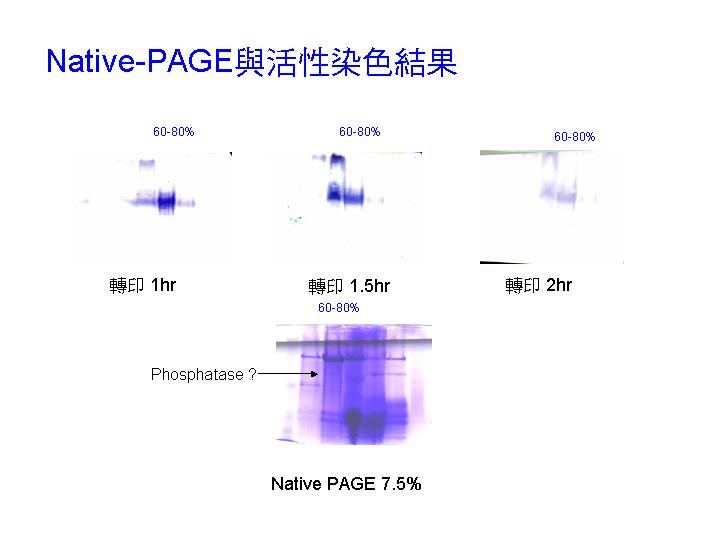
磷酸脢的純化流程需要再檢討,對 SPPK 所磷酸化的 SP 暫時看不到去磷酸的活性。 |
|
|
|
||
|
D1 |
L100 的純化要穩定: 純化步驟、菌的表現及誘導 (如 R2)。 |
|
|
D2 |
每張轉印圖都要有 CBR 對照,且電泳樣本一定要定蛋白質量。 |
* |
|
D3 |
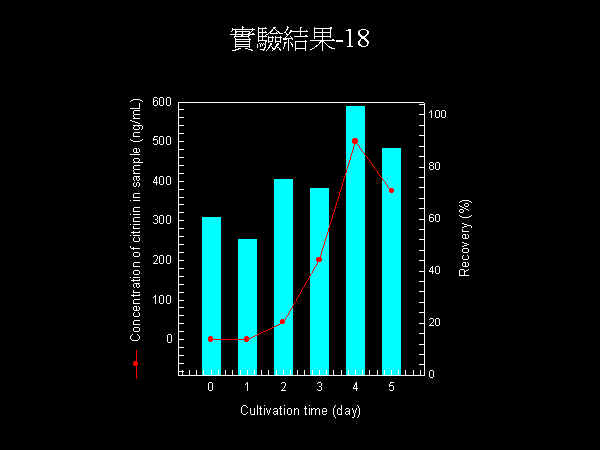
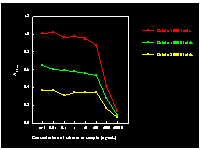
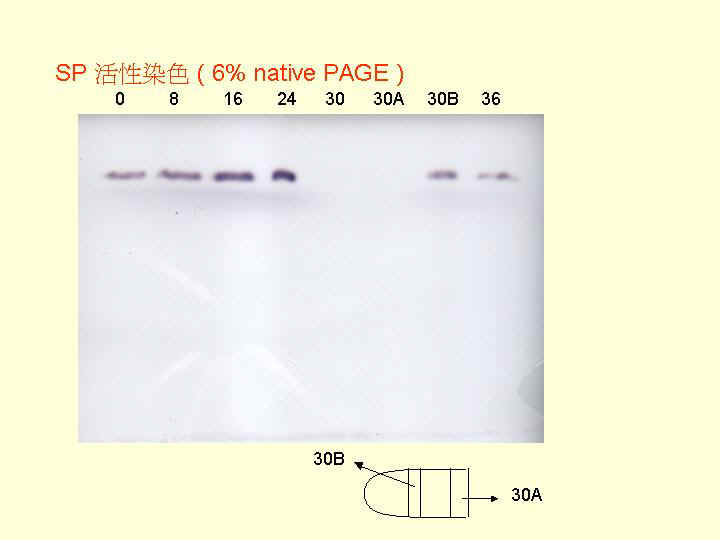
Phosphatase 硫酸銨分劃可收 50~90% 飽和度範圍。 |
|
|
D4 |
|
|
|
D5 |
|
* |
|
D6 |
|
* |
|
|
||
| ★ |
設計實驗要更嚴謹,各實驗步驟及試劑的規劃及定量等,都要更仔細。 |
|
|
還是以 L100 為論文主題,這些實驗應可順利做出來,但就是要更多嘗試與細心。 |
|
|
|
有任何結果或問題,請馬上與我討論,以免誤入岔路,消耗寶貴時間。 |
|
|
| 以上各項工作結果請於 下次報告 中提出檢討 | ||





wyr.jpg)