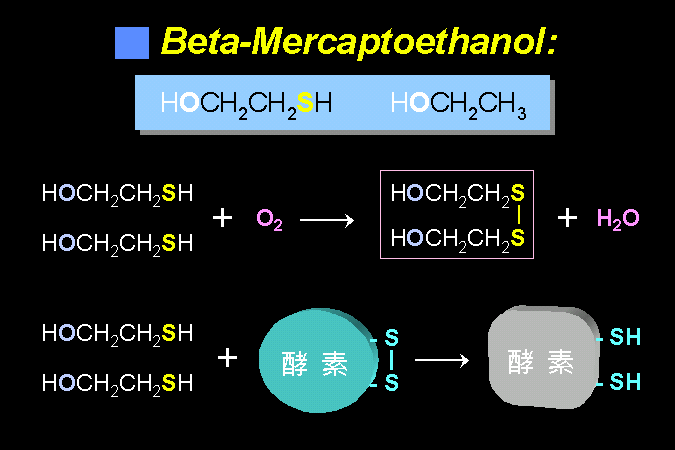
第三章 蛋白質
許多胺基酸連接在一起組成了蛋白質,因此蛋白質的性質基本上可由胺基酸的性質來推衍;但是因為一個個的胺基酸連成了長鏈,蛋白質的構造因此不但比較複雜,而且衍生出胺基酸所無法想像的次元與功能。
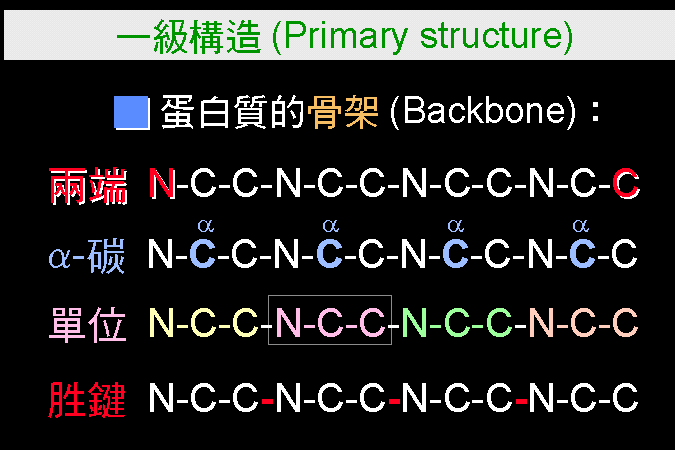
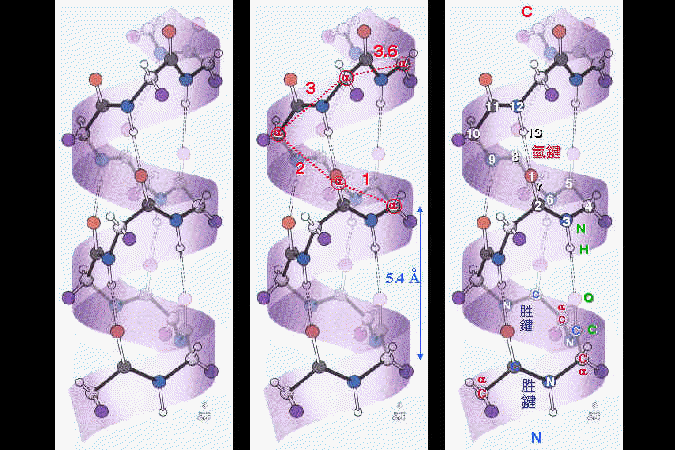
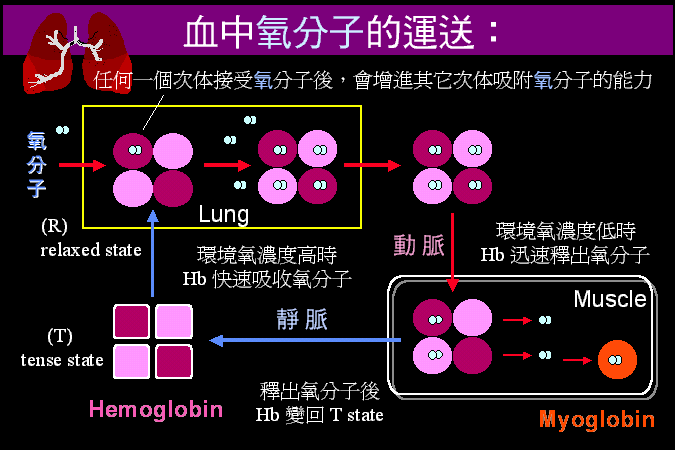
我們以人為的分類,把蛋白質的構造分成四種層次︰由胺基酸序列的 一級構造 開始,先捲繞成幾種固定的 二級構造,若干二級構造再組合成完整的 三級構造,成為蛋白質的一個分子。三級構造已經是蛋白質的獨立單位,可以有其生理及活性;但有些蛋白質分子,再次聚合若干如此的單元分子成為多元體,進而形成 四級構造,有更複雜的調節功用。
蛋白質是很具象的東西,學習蛋白質應注意其立體構造與功能的關係,在視覺上是一種愉快的經驗;因此要主動攝取並了解正確的分子概念,而非只是背誦一些分子構造與性質而已。
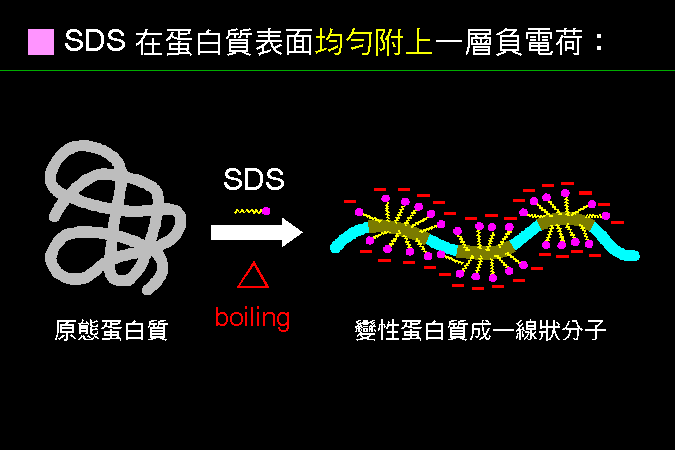
明白了蛋白質的構造之後,以此分子構造為根本,再去探討其性質;最重要的一點就是蛋白質必須維持其正確的分子形狀,也就是其 構形 (conformation)。蛋白質若失去正確的構形,就失去其活性與功能,稱之為變性 (denaturation)。 蛋白質最重要的性質,即如何保持其構形,如何導致變性,又如何回復其原態與功能,稱為復性 (renaturation)。
我們上課所說明的各章節,與 課本 的構造差不多,但較為廣泛而深入,請同學們一定要把課本看過一次,並做過習題。蛋白質部份更注重正確觀念的引導,請每次都要準時來聽課,以免漏掉重要的觀念。又因為上課時間實在太少,最好請每堂上課前先行預習,以免上課速度太快而跟不上。
■ 到講義相關部份