1.
Hemoglobin 並非酵素,但為何也會有部份裂解雙氧水 H2O2 的作用?
2.
為何 RNA 可能具有催化的能力?
3.
Carboxypeptidase A 分子的活性區需要一個 Zn 離子,請問此金屬離子有何作用?
4.
寫出下列各輔脢所能轉移的基團: ATP Coenzyme A NADPH Thiamine
5.
釀酒的時候,為何要把酒甕封起來?
6.
Glyceraldeyhyde-3-dehydrogenase 含有兩個 domains,請說明它們各有何種作用?
7.
有些酵素經過磷酸化後反而失去活性,請問其機制或原因何在?
8.
酵素活性區的構形與下列三者何者較能互補? 請說明為何?
基質、生成物、過渡狀態
9.
請寫出 Michaelis-Menten 公式,並說明其意義。
10.
說明為何 k3 就是 turnover number?
11.
檢討一個酵素的催化活性,採用 kcat /km 有何好處?
12.
寫出下列各種酵素抑制劑的作用機制:
a) Penicillin b) Sarin c) Sulfa drug d) Heavy metal
13.
為何 chymotrypsinogen 分子要先經過裂解後,才會變成活性型?
14.
Chymotrypsin 如何穩定所催化基質的中間過渡狀態?
15.
Chymotrypsin 的 His 57 對其催化機制有何貢獻?
16.
已知 DPF (diisopropyl phosphofluoridate) 是 Ser protease的 專一性抑制劑,請問如何證明 DPF 是攻擊酵素的活性區?
17.
大部份的 proteases 似乎都有相類似的水解機制,請說明此一核心機制。
18.
許多 proteases 的抑制劑本身都是蛋白質,請問為何這種蛋白質抑制劑不會被 protease 所水解,反而能夠抑制之?
19.
請任舉四種細胞生理上的現象,都是因於蛋白質裂解所造成的結果?
例如: Enkephalin 腦啡分子的生成
20.
如何以 非共價鍵 方式來調節肝醣磷解脢的活性?
21.
請問為何 異位脢 (allosteric enzyme) 的動力學作圖可得到一條 S 型曲線? 並說明此 S 型曲線有何意義。
22.
許多生理反應都以 梯瀑式 cascade 方式進行,請問會產生何種重大的效應?
23.
為何維持正確的酸鹼度 pH,對某些酵素的活性非常重要? 有無酵素不受 pH 影響?
24.
請寫出四種以上的蛋白質性質差異,可利用來作為蛋白質純化的依據。
例如: 分子量的大小不同
25.
抗體與其抗原極類似酵素及基質,有很強的專一性,但並無酵素的催化作用;而 catalytic antibody (或 abzyme) 為特別設計所產生的抗體,可使抗體具有催化的性質。 有一反應如︰ A+B → A-B ,而你要設計並生產能催化此反應的抗體 (A 與 B 均為小分子)。
a. 你將以何種分子為抗原? 詳細說明原因。 (hint: 為何酵素具有催化能力?)
b. 在進行免疫時,應當注意那些事項?
26.
請判斷並說明下列各題的真偽:
1) 酵素都是由蛋白質所構成的。
2) 金屬離子在酵素分子中,只有幫助維持構形,不直接參與催化反應。
3) Vmax 大,表示此酵素與基質的親和力越大。
4) 酵素分子中的胺基酸,可直接參與催化反應的,都是一些極性不太強的胺基酸。
5) Km 的單位是 濃度/時間。
6) 抑制劑 (inhibitor) 與 負效應物 (negative effector) 都可影響酵素活性,其差別在於後者一定是細胞的代謝產物,前者不然。
7) 分析酵素活性時,基質濃度不能太高 (差不多是 Km 的程度即可),以免干擾反應。
8) k3 = kcat = turnover number
9) Km 可看成 [ES] 的生成速率常數。
10) Serine proteases 都有由 Asp-His-Ser 組成的 triad,可產生一具高反應性的 -O- 基。
11) 一般酵素的活性區與專一性辨認區都不在同一位置,以便增加專一性。
12) 兩個蛋白質間的專一性結合,其構形的互補是重要條件之一,乃因於凡得瓦爾鍵。
13) 酵素的活性區多為一凹陷口袋,是因為要隔離掉影響催化反應的干擾因子。
14) 酵素的抑制劑對人類都有害,在環境或醫藥使用上應完全避免之。
15) 與磷酸化一樣,AMP 對肝糖磷解脢的調控,也是改變該酵素的分子構形。
16) 蛋白質激脢 (protein kinase) 的催化反應本身都是可逆的,因此蛋白質的磷酸化可以其逆反應來去除之。
17) 酵素只能增加其催化反應的反應速率。
18) 多元體酵素的存在是為了調控作用。
19) 只要所含的二十種基本胺基酸基團,蛋白質就可以充份發揮酵素的催化機制。
20) 酵素催化反應進行的過程中,酵素與基質或產物之間,都不能有共價鍵生成,這才能稱為催化。
21) 所有具有完整功能的酵素都是由一條完整胺基酸長鏈所構成的。
22) 若某酵素的動力學試驗得到一 S 型曲線,表示此酵素為多元體的四級構造。
23) 很多生物都含有血紅蛋白 (hemoglobin),其胺基酸序列同質性很高,因此其構形相似,都保有相同的運氧功能。
24) 水溶性蛋白質的疏水性胺基酸大都在分子的裡面,故酵素分子內部不可以有親水性胺基酸,以防止分子變性。
25) 剛轉譯出來的完整 chymotrypsin,其催化活性很低,是因為無法穩定過渡狀態。
26) 蛋白脢催化過程中,所形成過渡狀態有過多正電荷,要用氧原子上的電子中和之。
27) 尿素 (urea) 可導致酵素變性的原因是破壞 a 螺旋的氫鍵。
28) 基因的開關可以控制其蛋白質產物的表現,因此一但某基因被大量轉錄成 mRNA 後,即可預測下游蛋白質將會大增。
29) 以下配對都是因為專一性吸引力所造成: 抗原-抗體、荷爾蒙-受體、酵素-輔脢。
30) RNA 可以形成分子構形,而 DNA 則無;這是因為 DNA 為雙股螺旋所致。
31) RNA 可以形成分子構形,而 DNA 則無;是因為 RNA 可形成 非 Watson-Crick 配對。
32) 為何酵素的反應速率要看 k3? (vo = k3 [ES]) 是因為 k1 太大、而 k2 太小。
33) Steady state 理論是說,酵素在一定時間內會達到一平衡穩定的反應速率。
34) 青黴素是一種 serine protease 的抑制劑。
35) 磺胺藥是細菌代謝途徑的可逆型競爭性抑制劑,因此只能抑菌不能殺菌。
36) 電泳及離子交換法都是利用蛋白質分子極性的不同來進行分離純化的。
37) 葡萄糖要經磷酸化後才進入糖解代謝途,是因為要防止葡萄糖分子跑掉,因為磷酸化後的分子不易通過細胞膜。
38) 以誘生抗體所製備得的 abzyme,可催化所指定的反應,其效率更高於傳統酵素。
39) 同一 domain 可重複出現在不同酵素分子上,這是在基因層次已安排好的。
40) Carboxypeptidase A 是一種外切脢,可切除蛋白質 C-端的非極性胺基酸,它可以與 a-COOH 結合來辨識是否為 C-端。
27.
是非選擇題 (答案寫在 □ 內,是 →○、非 →×)
1) 酵素催化反應具有那些特性?
□ 可降低反應的活化能 □ 可以改變反應的平衡方向 □ 反應前後酵素化性沒有改變 □ 其催化速率是可以被改變的
2) RNA為何會有特定構形?
□ RNA 為單股長鏈分子 □ RNA 有 Watson-Crick pairing □ RNA 有非 W-C 的 pairing □ 氫鍵是主要貢獻力量 □ RNA 分子中有核糖的 2'-OH
3) 以下分子何者為酵素?
□ Insulin □ Trypsin □ Fibrin □ Hemoglobin □ Calmodulin
4) 有額外反應性基團的胺基酸:
□ Val □ His □ Glu □ Pro
5) NADH 分子中含有那些構造?
□ 去氧核糖 □ 磷酸 □ Adenine □ Hydride □ Nicotinamide
6) 輔脢的作用或性質為:
□ 穩定酵素構形 □ 參與反應基團的轉移 □ 很多含有去氧核糖核苷部份 □ 可提供一強力反應基團
7) 有關 Km 的敘述何者為真?
□ Km 的單位是 mM/sec □ Km = k2 ÷ (k1 + k3) □ Km 越大表示對基質結合力強 □ Km 隨著酵素的濃度變化而變 □ Km 與 ES 的生成無關
8) 有關 kcat 的敘述何者為真?
□ kcat 的單位是 sec -1 □ kcat 就是 k3 □ kcat 隨著酵素的濃度變化而變 □ kcat 與 ES 的生成無關
9) 可構成兩個分子間的專一性吸引力的力量有那些:
□ 氫鍵 □ 疏水鍵 □ 雙硫鍵 □ 凡得瓦爾力 □ 離子鍵 □ 分子間構形互補
10) 何者為 Ser protease 家族?
□ Subtilisin □ 凝血因子 VIII □ Acetylcholinesterase □ Elastase □ Thrombin
11) 何者為酵素的不可逆抑制劑?
□ Penicillin □ PCMB □ DFP □ EDTA □ 磺胺藥 □ cAMP
12) 改變下列那個胺基酸後會影響 chymotrypsin 的活性:
□ Asp 102 □ His 57 □ Ser 14 □ Ile 16 □ C-terminal
13) 有關立体專一性何者為真?
□ 碳原子的 sp3 軌道是主因 □ 自然界中多使用 L-胺基酸 □ 單糖分子並無立体異構物 □ 酵素可分辨基質立体異構物
14) 有關肝糖磷解脢的調節方式:
□ 可經磷酸化使酵素活性上升 □ cAMP 是 (+) 異位調節因子 □ ATP 是其競爭性抑制劑 □ 磷酸化會使其構形改變
15) 有關異位脢的作用方式:
□ 可能受其上游代謝物所抑制 □ 其動力學行為呈一 S 型曲線 □ 其 effector 的作用區即活性區 □ 異位脢不一定要有四級構造
28.
酵素動力學可以下式開始: E + S → ES → E + P ,請以公式或文字,說明由此式所衍生出來的四個基本觀察。
29.
胜肽鏈上可被 trypsin 專一性水解的胺基酸有哪兩種?
30.
請舉出六種以上可以使酵素失去活性的方法。
31.
請寫出蛋白質上可被磷酸化的胺基酸種類。
32.
右圖為某酵素的雙倒數動力學作圖,請依指示回答問題:
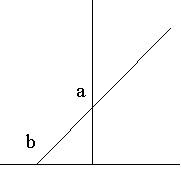
a) 請標示橫座標及縱座標及其單位。
b) 標明圖中 a 及 b 點各為何?
c) 若有一競爭性抑制劑 X,請在圖中畫出可能的抑制情形。
33.
依下列性質,請各至少出一種方法可以純化酵素:
a) 依分子 大小 不同 _____________________
b) 依分子 電荷 不同 _____________________
c) 依分子 極性 不同 _____________________
34.
請簡單解釋以下名詞: Abzyme Ribozyme Proteasome Specific activity
35.
異位脢是否一定要具有四級構造? 請詳細說明。
36.
為何輔脢多屬維生素?
37.
以人工定點突變可以改變酵素的重要胺基酸,進而改變酵素的催會特性,但是通常改變出來的新酵素,活性都較原來的酵素差,請問為何如此? 若果真如此,則此種定點突變修改酵素的方法,有何實際用途?
38.
生物細胞中,許多生理功能有『放大 amplification』的作用,例如信息傳導中的關鍵酵素 (cyclase, kinase),請再舉出數例。
39.
同上題,但並非屬生物細胞,而是人為的實驗方法中,有哪些是具有放大功能的?
40.
單醣分子可以說是一種 多醇醛,在一條碳鏈上連接以醇基,並在一端接有一醛基 (如葡萄糖)。在生物細胞內,以此種分子作為能量的貯存與攜帶;而地球把更多的能量藏在如汽油等的飽和碳氫化合物內 (如己烷)。 事實上後者含有更高的能量,是較好的能量貯藏分子。 請問細胞為何使用糖類分子,而非飽和碳氫化合物? 請以單醣的分子構造與特徵,說明其原因。