蛋白質體學與單株抗體應用 |
|
Proteomics and Monoclonal Antibody Tool |
|
|
|
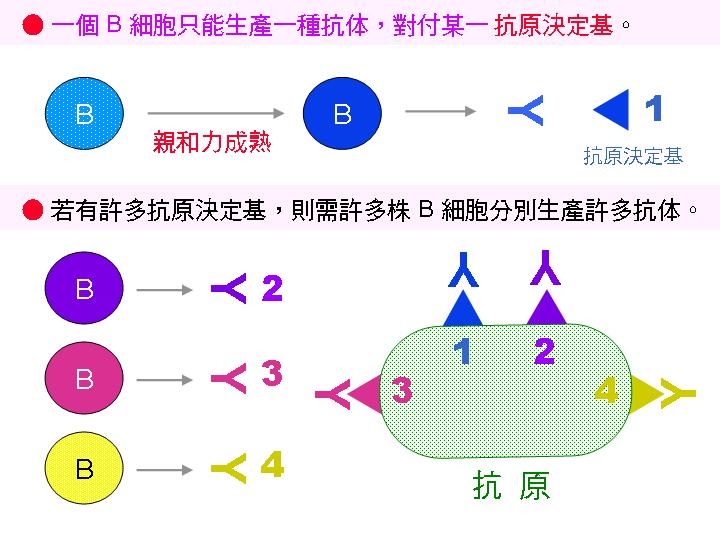
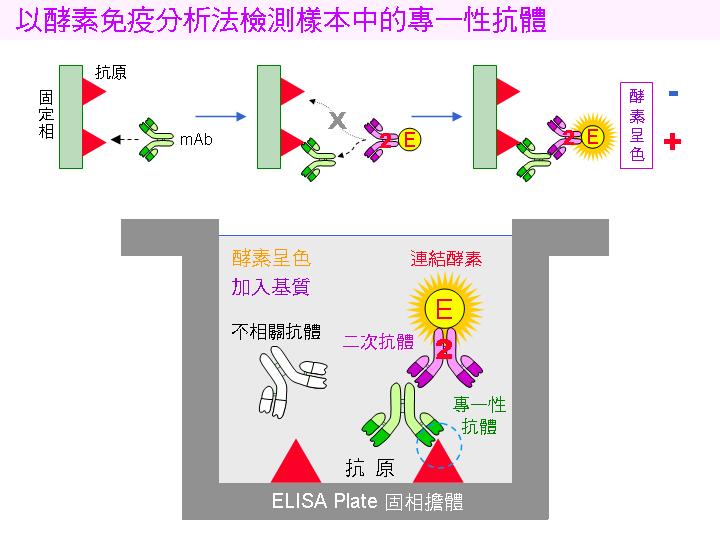
二次元電泳是研究蛋白質體的重要工具之一,可以方便解析細胞中的各種蛋白質,但所染出來的複雜蛋白質圖譜,通常都不太容易解讀。單株抗體是由人工製備所得到的專一性探針,可在複雜的二次元蛋白質圖譜,清楚地染出其所對抗的抗原蛋白質。這些能力使二次元電泳加上免疫轉印,成為分析蛋白質體極有用的利器。 |
|
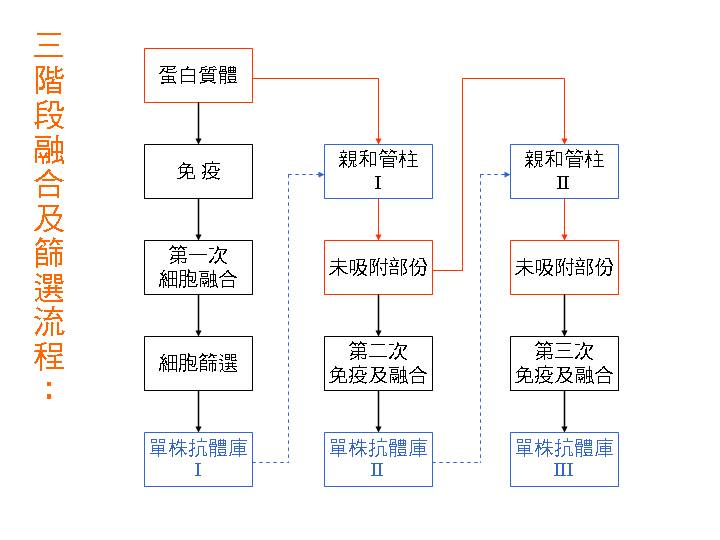
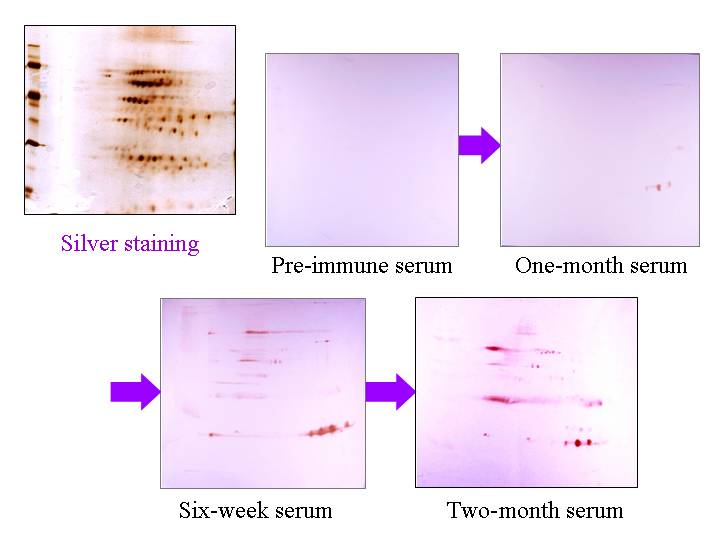
蛋白質體學的應用,是目前世界上熱門的概念與技術之一,這有其道理。因為掌握蛋白質體工具,等於多了一項超強的研究武器,可以看到傳統研究方法所無法觀察到的現象。這個工具對於生命科學之研究者而言,有如人類之發明輪子,或者發現電力一般重要。另外,蛋白質體學不只是一項工具的發明而已,也是整體研究觀念的改變,強迫科學家以整個細胞或生物的角度,去重新思考以往的研究問題;觀察角度不一樣,研究結果也會有很大的突破。 高產能 (high-throughput) 的概念,是在人類基因體計畫完成後,科學家開始要面對某一生物的全體基因開始的;因為每一個可表現的基因,都會產生其所對應的蛋白質,因此也由基因體學 (genomics) 衍生了蛋白質體學 (proteomics) 這個字,開始了蛋白質體學的應用。不論是基因體或蛋白質體,科學家必須處理數量龐大的基因或蛋白質,要以高產能的觀念來進行分離或檢定,有別於傳統的單一基因或蛋白質。而在處理數量龐大的蛋白質體時,如何快速而正確地檢定一個蛋白質的身分,是一個極關鍵的步驟。到目前為止,抗體仍是最方便而有效的方法,可以人工的製備流程,產生對目標蛋白質具有很高專一性的探針。 本章首先說明幾個主題觀念:(1) 蛋白質體學與二次元電泳、(2) 單株抗體的專一性及其應用、(3) 二次元電泳與免疫轉印的結合。然後提出一種想法,目的是把單株抗體的生產流程高產能化,並且配合蛋白質體學的發展與需要,嘗試製備整個蛋白質體中,大部分蛋白質的專一性抗體 (4),以便應用在蛋白體的快速檢定,以及將來可能的抗體晶片製作 (5)。若你對製備抗體庫的問題不是很有興趣,可以跳過第 (4) 部份,直接閱讀抗體庫的可能應用。 |
(1) 蛋白質體學與二次元電泳: |
|
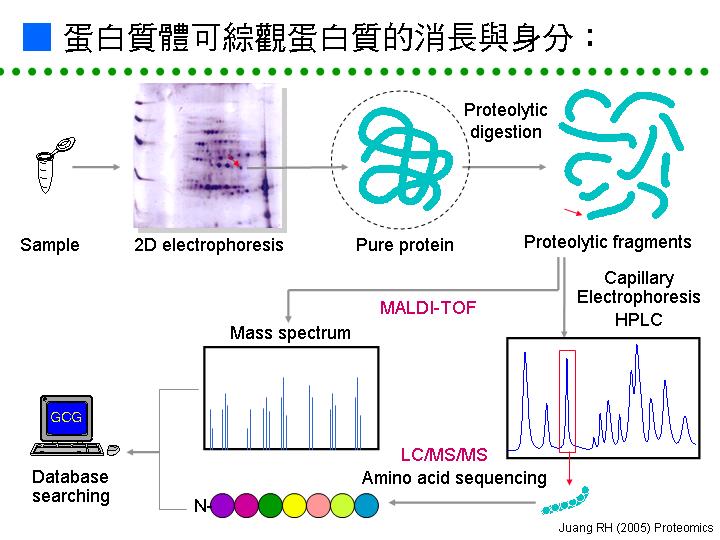
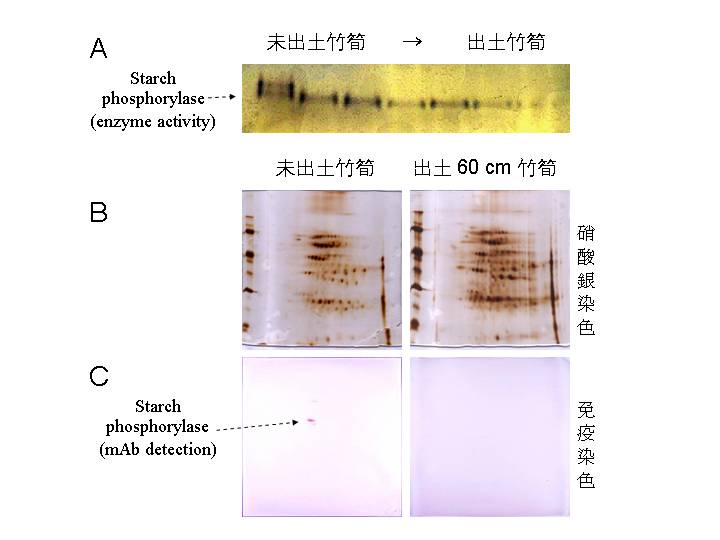
要探索一個細胞的全體蛋白質,很難找到完美的方法,因為蛋白質的性質不若核酸均一,每種蛋白質都有其自身的特別個性;比較方便而快速的工具就是 二次元電泳 (two-dimensional electrophoresis, 2DE): 2DE 把所抽取出來的蛋白質,先後以 等電焦集法 (IEF) 及 SDS-PAGE 進行分離,所有蛋白質在大約 20 cm 見方的膠片上分散開來,每一色點至少含有一種蛋白質,但同一種蛋白質可能會產生數個色點,這是因為蛋白質由基因轉錄後,還要經過各種修飾,因此會有許多變貌。 2DE 有許多先天上的缺點,最嚴重的是所看到的色點多寡,可能取決於抽取或分離方法的不同而有差異,一些微量或脂溶性的蛋白質不易抽出,因而很容易忽略掉關鍵蛋白質。雖然如此,2DE 還是較方便的折衷辦法,但在應用時要謹記其缺陷。 在收集了不同處理 (或突變株) 的生物樣本,分別以 2DE 比較其蛋白質體圖譜後,可以找出該變化所造成的蛋白質色點消長;這些有差異的色點可以直接挖出,並以蛋白質定序儀或質譜儀得知其部份胺基酸序列,配合已知蛋白質資料庫之搜尋與比對,就可得知該蛋白質色點的身分 (圖一)。 |
|
|
|
|
|
圖一 蛋白質體工具的圖示流程,說明如何快速檢定出蛋白質的消長與身分。 |
|
|
|
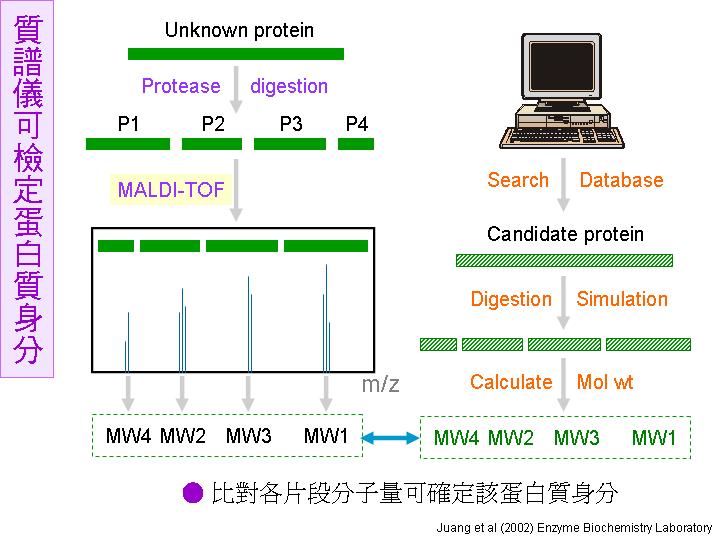
若該種生物的基因體已經被解碼,則有另一個檢定方法,就是把這個未知蛋白質 X 挖出來之後,先經過專一性的蛋白脢水解成各種長短的胜肽片段,再由質譜儀 (MALDI-TOF) 得知這些片段的精確分子量;另一方面,在其基因體資料庫中搜尋,若某一蛋白質 Y 以同一蛋白脢進行模擬水解,可得到相同的胜肽片段,則可以推斷未知蛋白質 X 的可能身分就是 Y (圖二)。 這樣所推得的結果相當可靠,但若你所研究生物的基因體還沒有解碼,就無法利用這個方法。 |
|
|
|
圖二
未知蛋白質先以專一性蛋白脢水解成胜肽片段,再經
MALDI-TOF
質譜儀可得知這些片段的精確分子量,與資料庫模擬水解片段比較後可判定其身分。 |
|
鑑定得到一系列具有明顯變化的蛋白質,就可串連出可能的代謝或反應途徑,進而解釋在生理方面的變化原因。另外,細胞內的任何一個蛋白質,一定與一種以上的蛋白質或其他分子,有著交互的作用關係;這種蛋白質與蛋白質間的交互關係,環環相扣成一個巨大的網狀關係,並深刻地影響該蛋白質的功能,以及整個細胞生理作用的調節。 以上所述基因體與蛋白質體的發展,啟動了 系統生物學 (systems biology) 的觀念,科學家對整體基因或蛋白質體的觀察,可用來探索以前所無法觸及的生理或生化問題。 |