|
3.3.1 |
�ܩʽ���q�a
(denaturing gel electrophoresis) |
�@ |
| �@ |
�@ |
�@ |
| �@ |
�b�i��
RNA �ܩʽ���q�a���R�ɡA�p�G�ҭn���R�� RNA ����p
(<1,000 bases)�A�i�H��λE���m�Q�i���� (polyacrylamide gel)�A���ɩҨϥΤ��ܩʾ�
(denaturing reagent) �D�n�O���� (urea)�F�o�Ӥ�k�@��]�Q�ΨӤ��R�ֻĩw�Ǥ����������C�Y�ұ����R��
RNA ���l���j�A�i���ܩʬv�潦��q�a (agarose gel
electrophoresis) ���R�A�ҨϥΪ��ܩʾ��� (1) glyoxal/dimethyl
sulfoxide (DMSO) (McMaster and Carmichall, 1977) �� (2) ���� (Lehrach
et al., 1977)�C �H glyoxal/DMSO
�t�ζi��q�a���R�ɡA�ҨϥΤ��q�a�w�IJG�� 10 mM sodium
phosphate buffer (pH 7.0)�F���F�קK�q�a�i��L�{���A�q�a�Ѩ��䤧
pH
���t�L�j�A�H�P�v�T�q�a���i��A�̦n��b�ⷥ�����[�˹q�a�w�IJG�`���˸m�A�ӥB�ֻĪa�ʳt�v�]�����q��C�C�H���Ǭ��ܩʾ��ɤ��|���o�ǰ��D�A�]���ާ@����٨ơA�������`�N�A���Ǯ��鬰���r����A�t�s���Ǭv�潦��ζi��q�a���R�����b����o�̾ާ@�C
������N�ĥΥ��Ǭv�潦��q�a�k�C
|
�@ |
| �@ |
�@ |
�@ |
|
3.3.1.1
|
�M�z�q�a�� |
�@ |
| �@ |
�@ |
�@ |
|
�@ |
�e���w�j�չL�A��_�N
RNase �h�����b�O RNA �������禨�\�P�_���D�n�M�w�]�l�C
�b�i�� RNA �q�a���R�ɡA���F�קK RNase
�i��a�Ӥ����D�A����Ǥ��̦n���˥X�@�M�q�a�����A�M���Ω�
RNA
�����R�C�p�G�ҨϥΪ��q�a�Ѥ�ű�����@��]�Ω�i��
DNA ���R���ܡA�b�i�� RNA
�ܩʽ���q�a���R�e���J�Ӧa�[�H�M�z�F�M�z�ɰ��F�H���ʲM�侯�����R�~���b�~�A�̦n�A��
3% �L��ƲB (H2O2) ���w10 min�C
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
������G
|
�@ |
|
�@ |
Mupid
II �g�A�q�a�Ѥ�ű����
|
�@ |
| �@ |
�ī~�վ��G
|
�@ |
|
�@ |
���ʲM�侯
(abSolve, DuPont NEF971)
|
�@ |
|
�@ |
3%
H2O2 (�L��ƲB)
|
�@ |
|
�@ |
dH2O/DEPC
|
�@ |
| �@ |
��k�B�J�G
|
�@ |
| �@ |
��
�`�N�G�i��U�C�B�J�ɡA�аȥ�����M�I
|
�@ |
| �@ |
1)
�H���ʲM�侯�J�ӲM�~�q�a�ѡA�A�H�G�����~�h�M�侯�A�õy�[�����C
|
�@ |
| �@ |
2)
�H 3%
�L��ƲB�`���q�a�ѡA��m��Ƿ� 10 min�C
|
�@ |
| �@ |
3)
�˱��L��ƲB���G�C
|
�@ |
| �@ |
4)
�H dH2O/DEPC �����a�R�~�q�a�ѡC
|
�@ |
| �@ |
�@ |
|
|
3.3.1.2
|
���Ǭv�潦��q�a
(formaldehyde-agarose gel electrophoresis) |
�@ |
| �@ |
�@ |
�@ |
|
�@ |
���ǬO�@�ر`�Ϊ�
RNA
�ܩʾ��C�b�i����Ǭv�潦��q�a���R�ɡA�������t�s�t�����Ǫ��v�潦��ARNA
�]�������H���Ǥ� formamide
�i���ܩʳB�z�A�H�T�O��G���c�R���Q���}�C�ѩ������i��O�@�حP������A�t�s����ζi��q�a���R�ɳ����b����o�̤p�߾ާ@�F�i��q�a�ɩҨϥΪ��w�IJG��
MOPS�C
���~�A�t�����Ǫ��v�潦�����ƷȡA�e���}���A�b���ʽ�������S�O�d���C�ѩ�
rRNA ���ӭM RNA �`�q�� 80~85%�A�H ethidium bromide
�V���A�e�{����W����ӥD�n RNA ��a���Ӥ��O�O
large �P small rRNAs (�u�֥ͪ��� 28S �P 18S�A��֥ͪ��� 23S
�P 16S)�F���G�� small rRNA ����A�e�H�H smear ���N�O mRNAs�A�o�O�]��
mRNAs �s�b�q���h�A�ӥB���פ��@���t�G�C�����u�� 5S
rRNA �� tRNA ���h�b����U��]�H�S�w��a�e�{�C
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
������G
|
�@ |
|
�@ |
65�J
���Ť���
|
�@ |
|
�@ |
�L�q���߾�
|
�@ |
|
�@ |
Mupid
II �g�A�q�a�Ѥ�ű����
|
�@ |
|
�@ |
UV
transilluminator
|
�@ |
|
�@ |
���@���n
|
�@ |
|
�@ |
��߱o�۾�
|
�@ |
|
�@ |
����o
|
�@ |
| �@ |
�ī~�վ��G
|
�@ |
|
�@ |
�۵�������
RNA (I-1, I-2, U-1, and U-2)
�P�M�~��������һs�Ƥ����N�ѤΤϷN�� RNA (#1, #2, #3,
and #4)�C
|
�@ |
|
�@ |
5��formaldehyde
gel running buffer (0.1 M MOPS, pH 7.0; 40 mM sodium acetate; 5 mM EDTA)
|
�@ |
|
�@ |
Formaldehyde
gel loading buffer (0.25% bromophenol blue; 0.25% xylene cyanol; 50%
glycerol; 1 mM EDTA)
|
�@ |
|
�@ |
Ethidium
bromide (1 mg/mL in dH2O/DEPC
|
�@ |
|
�@ |
dH2O/DEPC
|
�@ |
| �@ |
��k�B�J�G
|
�@ |
| �@ |
��
�`�N�G
|
�@ |
| �@ |
a.
�U�C����D�n�ѷ�
Sambrook et al. (1989) ����k�C
|
�@ |
| �@ |
b.
�i��U�C����ɽаȥ�����M�C
|
�@ |
| �@ |
c.
���ǻP
formamide
����b����o���C
|
�@ |
| �@ |
�@
|
�@ |
| �@ |
�dzƤ@��
1.2%
���Ǭv�潦��G
|
�@ |
| �@ |
1)
���� 0.48 g agarose �m 100 mL ��M�~�A�[�J 25 mL dH2O/DEPC�C
|
�@ |
| �@ |
2)
�H�L�i�l�[�����Ѥ���A�L�L�̰ʦ�M�~�ϲV�X���áA�A����
60�J ���Ť����R�m 5 min�C
|
�@ |
| �@ |
3)
�N�˵� agarose ���G����M�~���ܩ���o�A�[�J 8 mL �� 5��
formaldehyde gel running buffer �� 7.2 mL
�����ǡA�����n�̦�M�~�H�K�V�X���áC
|
�@ |
| �@ |
��
�����`��n�� 40 mL�A���F�קK agarose
���G�]�ūקֳt�U���A�ܧ֫K���T�A���O�D�ʧ@���t�A�����קK�@�P�n�̡A�H�K�˥X�@�j���w�A�v�T���龮���C
|
�@ |
| �@ |
4)
���t�����o����V�X�G�ˤJ����ű�ҡA�ô��J�˥���
(teeth comb)�C
|
�@ |
| �@ |
��
���龮�T�ܤֻݮ� 30
min�C
|
�@ |
| �@ |
�@
|
�@ |
| �@ |
�s�ƹq�a���R�һݤ�
RNA �˥��G
|
�@ |
| �@ |
1)
���X 8 �� 1.5 mL �L�q���ߺޡA���O�Хܬ� U-1, U-2, I-1, I-2,
#1, #2, #3 �� #4�A�îھڤU���ҥܨ̧ǥ[�J�U���վ� (��n��쬰
mL)�C
|
�@ |
| �@ |
��
U-1, U-2, I-1 �� I-2
���O���j�z��ߩҤ��o�� RNA (3.1.1
�`)�A#1, #2, #3�� #4 ���O�O�M�~��������ұo�줧 RNA (3.1.2
�`)�C
|
�@ |
| �@ |
|
|
I-1,
I-2
|
U-1,
U-2
|
#1
|
#2
|
#3
|
#4
|
|
Reagents
|
RNA
from pQG11/M15[pREP4]
|
RNA
from pQG11/M15[pREP4]
|
Tx-pBlueGus/
HindIII
|
Tx-pBlueGus/
BamHI
|
Tx-pBlueGus/
HindIII
|
Tx-pBlueGus/
BamHI
|
|
+ IPTG
|
�V IPTG
|
e/
DNase |
e/
DNase |
e/o
DNase |
e/o
DNase |
|
dH2O/DEPC
|
4.5
- x
|
4.5
- x
|
2.5
|
2.5
|
2.5
|
2.5
|
|
RNA
|
x
(6 mg)
|
x
(6 mg)
|
2
|
2
|
2
|
2
|
|
5��formaldehyde
gel-running buffer
|
2
|
2
|
2
|
2
|
2
|
2
|
|
Formaldehyde
|
3.5
|
3.5
|
3.5
|
3.5
|
3.5
|
3.5
|
|
Formamide
|
10
|
10
|
10
|
10
|
10
|
10
|
|
Total
volume
|
20
|
20
|
20
|
20
|
20
|
20
|
|
�@ |
| �@ |
2)
�V�X���è����Ƭ���A��m�� 65�J ���Ť��ѧ@�� 15 min�C
|
�@ |
| �@ |
3)
�N�@�Χ����L�q���ߺ��m��B�D���C
|
�@ |
| �@ |
4)
���Ƭ���A�A�N���ߺީ�^��B�D���A�é�U���ߺޤ��O�[�J
2 mL �� formaldehyde gel loading buffer �P 1 mL
ethidium bromide�C
|
�@ |
| �@ |
�@
|
�@ |
| �@ |
�q�a�G
|
�@ |
| �@ |
1)
�n�i��q�a�ɡA��w���T���v�潦���i�q�a�ѡA�å[�J�A�q
1��formadehyde gel running buffer�C
|
�@ |
| �@ |
2)
�H 50 V �w�q���w�] 5 min�C
|
�@ |
| �@ |
3)
�̧Ǫ`�J�W�C 8 �� RNA �˥��A�H 50 V
�w�q���i��q�a�A�ݰl�ܬV�����ʦܽ���T�����G�B�ɡA�����q���A�N���鲾��
UV transilluminator box�A�[�� RNA
��a���s�b���ΡA�é�Ӧs�ҡC
|
�@ |
| �@ |
u
�`�N�G
�o�@�����驹�U�N�ΨӶi��_����L����A�Фp�߳B�m�I
|
�@ |
| �@ |
���ѰQ�סG |
�@ |
| �@ |
a.
���[���W RNA
��a���s�b���ΡA�A���D���̦U�N������ܡH
|
�@ |
| �@ |
b.
�Y�A��������S�w mRNA ���l�����סA���p��i��H
|
��
|
| �@ |
�@ |
|
|
3.3.1.3
|
�H��Ӻ��ಾ�覡�i��_����L���� |
�@ |
| �@ |
�@ |
�@ |
|
�@ |
�n�i��_�����X�����e�A�������N
RNA �۬v�潦���ಾ�ܵv���ֺ��� (nitrocellulose membrane)
�Υ��s�� (nylon membrane) �W�A�o�@�ӹL�{�٬� ��L
(blotting)�C �@��`�Ϊ���k�]�A��Ӻ��ಾ�k (capillary
transfer, Alwine et al., 1977)�B�u���ಾ�k (vacuum transfer,
Peferoen et al., 1982) �P�q��L�k (electroblotting, Smith et al.,
1984)�C
��Ӻ��ಾ�k�ɧU�l���ȧl���ಾ�w�IJG�ɩҲ��ͪ��o�ޤO�q�N
RNA �۬v�潦���ಾ�ܽ��W�F�n��L�����A�_�X�ݭn�@�� 6
h �H�W�C
���M�һݪ�O���ɶ�������A�H�䤣���n�S�O�������]�ơA��Ӻ��ಾ�k�ثe���Q���M�ĥΡC
�Y���R RNA
�ɡA�ĥ��ܩʻE���m�Q�i����q�a�A�h�����H�q��L�k�i��
RNA
��L�C�ܩ���ܡA�v���ֺ��������u�I�O������|���ͫD�M�@�ʤ����F���L��@���Q���æA�M������A�e���H���A���A�Ω�i��h�����X�����C
���s�����u�I�O���ʦn�A�P�ֻĵ��X����O�]�۷��j�A�ҥH���i�H���ɵv���ֺ����������I�C
�@���N RNA �ಾ�ܽ��W��A�Y�i�H�Q�ε��~�u�Ӯg�k (uv
irradiation) �ίu�Ű���k (�b�u�ŤU 80�J �[�� 2 h)
�N��T�w����L���W�C
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
������G
|
�@ |
| �@ |
�콦��
|
�@ |
|
�@ |
�����O
|
�@ |
|
�@ |
���ȤM
|
�@ |
| �@ |
�ī~�վ��G
|
�@ |
|
�@ |
20��SSC
(3 M NaCl, 300 mM sodium citrate)
|
�@ |
|
�@ |
���s��
|
�@ |
|
�@ |
3MM
�o��
|
�@ |
|
�@ |
�l����
|
�@ |
|
�@ |
dH2O/DEPC
|
�@ |
| �@ |
��k�B�J�G
|
�@ |
| �@ |
1)
�N���Ǭv�潦�鲾��b�콦�����A�H dH2O/DEPC
�R�~�Ʀ��A�H�K�h�����ǡC
|
�@ |
| �@ |
u
�`�N�G�b���ʽ���ɽЯS�O�d�ߡA���n�⽦��˯}�F�I
|
�@ |
| �@ |
2)
�`�J 100 mL 20��SSC�A�R�m 5 min�C
|
�@ |
| �@ |
3)
�ھڹ� 3.2
�ҥܡA�̧Ǧb�콦���W���|�����O�B�o�� (�@���Q��)�B�q�a���B���s���B�T�h�o�ȡB�P�l���ȡA�H�K�H��Ӻ��ಾ�覡�N
RNA ��L���s���W�F�콦�����ˤJ�A�q 20��SSC�A�H�K�@���ಾ�w�IJG�C
|
�@ |
| �@ |
u
�`�N�G
|
�@ |
| �@ |
a. �o�ȻP���s�������H 20��SSC
����A�A����|�C
|
�@ |
| �@ |
b.
�b�o�ȡB���s���B�P�q�a�����h���i��|����w�s�b�A�]���b��n�q�a���B���s�����o�ȫ�A���ߧY�˵��A�åH���������������覡�p������w�C
|
�@ |
| �@ |
c.
����L�B�J�N����ܹj�Ѥ~�����C
|
�@ |
|
F3.2
|
�@ |
�@ |
| �@ |
�@
|
�@ |
| �@ |
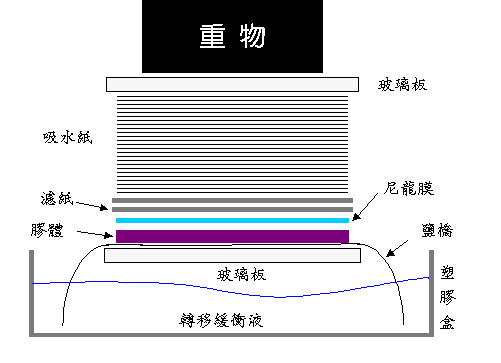
|
�@ |
| �@ |
��
3.2 �H��Ӻ��ಾ�k�i��ֻ���L
|
|
| �@ |
�@ |
�@ |
| �@ |
�@
|
�@ |
| �@ |
���ѰQ�סG |
�@ |
| �@ |
a.
���ϩҭn���R�� RNA ���פj�� 2.5 kb�A�b�i���Ӻ��ಾ�e�A����̦n���H
0.05 N NaOH �B�z 20 min�A�A�H 20��SSC
���w 40 min�A�H�K�������� RNA�A������L�IJv�C
|
��
|
| �@ |
�@ |
|
|
3.3.2 |
�_�����X���� |
�@ |
| �@ |
�@ |
�@ |
| �@ |
�_�����X�������B�J�D�n�]�A�G
(1) �[�J�ֻı��w�A�ϻP�T�w���s���W���S�w RNA
�i�����X�����A�� (2) �����X����������H�t�Q�w�IJG�P
SDS �~���D�M�@�ʵ��X���s���W���ֻı��w�C
�i����������`�N�U�C�X�Ӱ��D�G (1)
����ާ@�L�{�������i���קK RNase ���ìV�F(2)
�����e�����i�����X�e�m���� (prehybridization)�A�H�K��ֻ֮ı��w�P���s���������D�M�@�ʵ��X�����F(3)
�p�G�ҨϥΪ��ֻı��w�O�H random priming �� PCR
����k�һs�ƪ����� DNA ���w�A�ϥΫe�ȥ����[�ܩ�
(denature)�F(4) ��ξA�����Y�V�� (stringency)
�i�����X�����Τ����᪺���s���}�~�u�@�A�H�K�W�j���X�����T���A�ô�����T�A�o�D�n�i�H�q�ūP�Q�@�ר�Ӥ譱�[�H�Ҷq�C
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
������G
|
�@ |
|
�@ |
Crosslinker
(Stratalinker 1800,
Stratagene)
|
�@ |
|
�@ |
�콦��
|
�@ |
|
�@ |
�����h�l
|
�@ |
|
�@ |
�ʤf��
|
�@ |
|
�@ |
42�J
���ż�
|
�@ |
|
�@ |
60�J
���ż�
|
�@ |
| �@ |
�ī~�վ��G
|
�@ |
|
�@ |
6��SSC
(0.9 M NaCl, 90 mM sodium citrate)
|
�@ |
|
�@ |
���s��
|
�@ |
|
�@ |
4
M LiCl
|
�@ |
|
�@ |
Hybridization
solution [formamide, 50% (v/v); 5��SSC; blocking reagent, 2% (w/v); N-lauroylsarcosine,
0.1% (w/v); SDS, 0.02% (w/v)]
|
�@ |
|
�@ |
3MM
�o��
|
�@ |
|
�@ |
2��SSC,
0.1% SDS
|
�@ |
|
�@ |
0.1��SSC,
0.1% SDS
|
�@ |
| �@ |
��k�B�J�G
|
�@ |
| �@ |
u
�n�����X�����аѷ� 6)
���᪺�B�J�i��A���ҨϥΤ����w�� 3.2.1
�`�H random priming
�i��Щw�̡C�i��U�C����ɡA�аȥ��a��M�C
|
�@ |
| �@ |
1)
RNA
��L�B�J������A�����q�a���W���l���ȻP 3MM �o�ȡC
|
�@ |
| �@ |
2)
�⥧�s���s�P�q�a���@�����m�b�åͯȤW�A�ýФp�ߺ����q�a���P���s�����۹��m�C
|
�@ |
| �@ |
3)
�H�������b���s���W�ХX�q�a���˥��ժ���m�A�åH�ŤM�ű����s�����W���A�H�K�аO�q�a�������k���C
|
�@ |
| �@ |
4)
�p�ߦa�Զ}���s���A�N����m�� 6��SSC (20 mL) ���w 5 min�C
|
�@ |
| �@ |
5)
�H�����h�l���_���s���A�� 6��SSC
�w������A�⥧�s�������åͯȤW�A�����ܤ� 30 min�C
|
�@ |
| �@ |
u
�P�q�a����IJ�����@�����¤W�C
|
�@ |
| �@ |
6)
�H Stratalinker 1800 �i�� uv �s�������C
|
�@ |
| �@ |
7)
���X�e�m�����G
|
�@ |
| �@ |
a)
�N 10 mL ���X���G�`�J�@�Ӷ콦�U�C
|
�@ |
| �@ |
b)
��w�g���������s�����m��콦�U���A�p�ߦa���w��������A�H�ʤf���K�ʦn�A�A����
42�J ���żѶi�����X�e�m���� 1~2 h�C
|
�@ |
| �@ |
8)
�ֻı��w�ܩʤ����G
|
�@ |
| �@ |
a)
�H�L�q�l�ޤp�ߦa�� PCR �������ܷs���L�q���ߺޡC
|
�@ |
| �@ |
b)
�N�˵ۮֻı��w���L�q���ߺީ�J�m�����[�� 10 min�C
|
�@ |
| �@ |
u
�P�q�a����IJ�����@�����¤W�C
|
�@ |
| �@ |
c)
�����ߺ��J�B�D���R�m 3 min�C
|
�@ |
| �@ |
d)
�������߫�A���X�w�Q�ܩʪ��ֻı��w�A�[�� 5 mL
�����X���G�C
|
�@ |
| �@ |
9)
���X�����G
|
�@ |
| �@ |
a)
�Ŷ}�콦�U�@���A�˥X�콦�U�����X�e�m�����ҨϥΤ����G�A�å[�J�s�t���t���ֻı��w�����X���G
(8-d)�C
|
�@ |
| �@ |
b)
�p�߲�����w�A�åH�ʤf���K�ʶ콦�U�C
|
�@ |
| �@ |
c)
�p�e�`�ҭz�N�콦�U���� 42�J
���żѡA���X�����N�i��L�]�C
|
�@ |
| �@ |
10)
�H�t�Q�w�IJG�P SDS �}�~��L�� (Northern
blot)�G
|
�@ |
| �@ |
a)
���X�콦�U�A�콦�貰�H�M���R�~���b����A�ˤJ 80 mL
[2��SSC, 0.1% SDS]�C �Ŷ}�콦�U�A�⥧�s�����X��i [2��SSC,
0.1% SDS]�A��Ƿź}�~ 2 ���A�C�� 5 min�C
|
�@ |
| �@ |
b)
��H 100 mL [0.1��SSC, 0.1% SDS] �� 60�J �~ 2 ���A�C�� 15 min�C
|
�@ |
| �@ |
�@
|
�@ |
| �@ |
���ѰQ�סG |
�@ |
|
�@
|
a.
�b�i��B�J 6) �� uv
�s����������A�Y�L�k�ߧY�i��_�����X�����A�i�N���s����J�콦�U���A�é�m��
-20�J �B�c�O�s�C
|
�@
|
|
�@
|
b.
�b�����B�J 10) ����L���}�~�u�@��A�Y�L�k�ߧY�i��
DIG
�ï��s���K�̤����P�P�ʥh�C���Q�e������A�i�N��L����J�콦�U���A�é�m��
4�J �B�c�O�s�C
|
�@
|
|
�@
|
c.
�̫�H [0.1��SSC, 0.1% SDS]
�}�~��L���ɡA�ҥΪ��ūץi�̹�ڻݭn�A�վ�A�H�K�h���D�M�@�ʤ����A������T�C
|
�@
|
|
�@
|
d.
�@���٥i�H�ǭ��Ǥ覡�������X�������Y�V�סH
|
��
|
| �@ |
�@ |
|
|
3.3.3 |
�H�ï��s���K�̤����P�P�ʥh�C���Q�e������������X�T�� |
�@ |
| �@ |
�@ |
�@ |
| �@ |
�i�����X�����ɩҨϥΪ����w�Y����g�ʪ���ҼЩw�̡A���X�T���i�g�ѩ�g��v�N
(autoradiography) �����X�ӡF�Y�� DIG �ҼЩw�̡A�h�ݭɧU
anti-DIG ����P�P�ʥh�C���Q (alkaline phosphatase, AP) ��
conjugate�A�çQ���P�ʥh�C���Q���ï�������{���X�����T���C
�ثe�`�ΨӶi���P�ʥh�C���Q�e���������謰 NBT (nitroblue
tetrazolium) �P BCIP (5-bromo-4-chloro-3-indolyl phosphate, toluidinium
salt)�F ���~�A�]�i�H��� CSPD �� CDP-Star
���վ��A�H�W�[�˴��ӷP�סC
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
������G
|
�@ |
|
�@ |
�����h�l
|
�@ |
|
�@
|
����n����
(rotary shaker)
|
�@ |
| �@ |
�ī~�վ��G
|
�@ |
|
�@ |
DIG
nucleic acid detection kit (Roche), ���t�G
|
�@ |
|
�@
|
Anti-DIG-AP
conjugate
|
�@ |
|
�@
|
NBT/BCIP
stock solution
|
�@ |
|
�@
|
Blocking
reagent
|
�@ |
|
�@
|
Washing
buffer (buffer 1 + 3% Tween 20, v/v)
|
�@ |
|
�@
|
Maleic
acid buffer (0.1 M maleic acid; 0.15 M NaCl; adjust to pH 7.5 with NaOH)
|
�@ |
|
�@
|
Blocking
solution (1% blocking reagent in maleic acid buffer)
|
�@ |
|
�@
|
Detection
buffer (0.1 M Tris-HCl, pH 9.5; 0.1 M NaCl; 50 mM MgCl2)
|
�@ |
|
�@
|
TE
(10 mM Tris-HCl, pH 8.0; 1 mM EDTA)
|
�@ |
|
�@
|
Color-substrate
solution (�ݭn�ϥήɨ� 10 mL �� detection buffer�A�[�J 200 mL
NBT/BCIP stock solution ���òV�X)
|
�@ |
| �@ |
��k�B�J�G
|
�@ |
| �@ |
u
�`�N�G
|
�@ |
| �@ |
a.
�H�U��������P�{�ǥD�n�O�ѷ�
DIG nucleic acid detection kit
�s�y�t�өҴ��Ѥ����~�����ѡC
|
�@ |
| �@ |
b.
�_��P�n�����X�����s���i�P�B�B�z�A�Ҧ�������ǷŶi��C
|
�@ |
| �@ |
c.
�H�����h�l�N���s���ۤ@�ط��G���ܦ��@�ط��G�ɡA���i��w���e�̤��ݯd�����A�H�K�v�T��������C
|
�@ |
| �@ |
d.
���~�L�{���H�n�����C�t�n�� (50 rpm)�A�H�K�[�j�@���C
|
�@ |
| �@ |
1)
�i�� anti-DIG/AP conjugate �P
DIG-�ֻı��w���K�̵��X�����G
|
�@ |
| �@ |
a)
�H 50 mL �� washing buffer ���~���s�� 1 min�C
|
�@ |
| �@ |
b)
Blocking�G�⥧�s����J 20 mL blocking solution �@�� 30 min�A�H�K��R���s���W���D�M�@�ʵ��X����C
|
�@ |
| �@ |
c)
���X 2 mL �� anti-DIG-AP conjugate�A�åH
10 mL �� blocking solution �}���C
|
�@ |
| �@ |
d)
�K�̵��X�����G�� anti-DIG-AP conjugate
�}���G�s�P���s���@�_��J�콦�U���A�J�Ӱ��h��w�ëʤf����A�C�t�n�ʧ@��
30 min�C
|
�@ |
| �@ |
e)
�H 50 mL washing buffer ���~���s�� 2 �� (�C�� 15 min)�A�H�K�h���h�l�ΫD�M�@�ʵ��X���s����
anti-DIG-AP conjugate�C
|
�@ |
| �@ |
f)
�N���s����m�� 20 mL �� detection buffer �}�~ 2 min�C
|
�@ |
| �@ |
2)
�P�ʥh�C�Ļï��e������G
|
�@ |
| �@ |
a)
���X���s���A��J 10 mL �{�t��
color-substrate solution�A���H�Y�⥧�s���Χ@�η��G���ܶ·t����
(�Ҧp��P��)
�@�ΡC�C�X�����˵��@���A�ݵ�����a�X�{�ɧY�i�פ�����C
|
�@ |
| �@ |
b)
���פ�����ɡA�Ч⥧�s������ 50 mL TE ���{ 5 min�C
|
�@ |
| �@ |
c)
���X���s���A�w�������G���m��åͯȤW�����ܤ� 30
min�A�[�H�@���Y�i�O�s�C
|
�@ |
| �@ |
���ѰQ�סG |
�@ |
| �@ |
a.
�i�Ψөw�q RNA
����k�A���F�_�����X���R���~�A�٦� primer extension, S1
mapping, RNase protection �� reverse transcriptase-PCR
���F�o�Ǥ�k�U����S��A�i�̬�s���e���ݭn��ܨϥΡC
|
�@
|
| �@ |
b.
�Y������ݭn�A���H���P�ֻı��w��P�@�i��L���i��h�����X�����ɡA���`�N�H���O����L���ü��A�_�h�i��|�]��L�����z�A�L�k�h�����W�����X�T���A�Ӽv�T�F�������X�����C
|
|
| �@ |
��
���G�Ѧҡy�����zSlide
7
|
��
|
| �@ |
�@ |
|
|
| �@ |
�ѦҤ��m�G |
�@ |
| �@ |
Alwine
JC, Kemp DJ, Stark GR (1977) Method for detection of specific RNAs in
agarose gels by transfer to diazobenzyloxymethyl paper and hybridization
with DNA probes. Proc Natl Acad Sci USA
74: 5350-5354
|
�@ |
| �@ |
Berger
SL, Birkenmeier CS (1979) Inhibition of intractable nucleases with
ribonucleoside-vanadyl complexes: Isolation of messenger ribonucleic acid
from resting lymphocytes. Biochemistry
18: 5143-5149
|
�@ |
| �@ |
Blackburn
P, Wilson G, Moore S (1977) Ribonuclease inhibitor from human placenta. Purification and properties. J Biol Chem
252: 5904-5910
|
�@ |
| �@ |
Bulter
ET, Chamberlin M (1982) Bacteriophage SP6-specific RNA polymerase. I.
Isolation and characterization of the enzyme. J
Biol Chem 257: 5772-5778
|
�@ |
| �@ |
Challberg
MD, Englund PT (1980) Specific labeling of 3' termini with T4 DNA
polymerase. Methods
Enzymol 65: 39-43
|
�@ |
| �@ |
Chirgwin
JM, Przybyla AE, MacDonald RJ, Rutter WJ (1979) Isolation of biologically
active ribonucleic acid from sources enriched in ribonuclease. Biochemistry
18: 5294-5299
|
�@ |
| �@ |
Davanloo
P, Rosenberg AH, Dunn JJ, Studier FW (1984) Cloning and expression of the
gene of bacteriophage T7 RNA polymerase. Proc
Natl Acad Sci USA 81: 2035-2039
|
�@ |
| �@ |
Fedorcsak
I, Ehrenberg L (1966) Effects of diethyl pyrocarbonate and methyl
methanesulfonate on nucleic acids and nucleases. Acta Chem Scand 20:
107-112
|
�@ |
| �@ |
Feinberg
AP, Vogelstein B (1983) A technique for radiolabeling DNA restriction
endonuclease fragments of high specific activity. Anal Biochem 132:
6-13
|
�@ |
| �@ |
Klenow
H, Henningsen I (1970) Selective elimination of the exonuclease activity
of the deoxyribonucleic acid polymerase from Escherichia coli by
limited proteolysis. Proc Natl Acad Sci USA
65:168-175
|
�@ |
| �@ |
Krieg
PA, Melton DA (1984) Functional messenger RNAs are produced by SP6 in
vitro transcription of cloned cDNA. Nucl Acids Res 12: 7057-7070
|
�@ |
| �@ |
Lehrach
H, Diamond D, Wozney JM, Boedtker H (1977) RNA molecular weight
determinations by gel electrophoresis under denaturing conditions: A
critical reexamination. Biochemistry
16: 4743-4751
|
�@ |
| �@ |
MacDonald
RJ, Swift GH, Przybyla AE, Chirgwin JM (1987) Isolation of RNA using
guanidinium salts. Methods Enzymol 152: 219-227
|
�@ |
| �@ |
McMaster
GK, Carmichael GG (1977) Analysis of single and double stranded nucleic
acids on polyacrylamide and agarose gels by using glyoxal and acridine
orange. Proc Natl Acad Sci USA 74:
4835-4838
|
�@ |
| �@ |
Melton
DA, Krieg PA, Rebagliati MR, Maniatis T, Zinn K, Green MR (1984) Efficient
in vitro synthesis of biologically active RNA and RNA hybridization probes
from plasmids containing a bacteriophage SP6 promoter. Nucl Acids Res 12:
7035-7056
|
�@ |
| �@ |
Morris
CE, Klement JF, McAllister WT (1986) Cloning and expression of the
bacteriophage T3 RNA polymerase gene. Gene 41: 193-200
|
�@ |
| �@ |
Mullis
K., Faloona F, Scharf S, Saiki R, Horn G, Erlich H (1986) Specific
enzymatic amplification of DNA in vitro: The polymerase chain reaction.
Cold Spring Harbor Symp Quant Biol 51: 263-273
|
�@ |
| �@ |
Peferoen
M, Huybrechts R, Deloof A (1982) Vacuum-blotting: A new simple and
efficient transfer of proteins from sodium dodecyl sulfate-polyacrylamide
gels to nitrocellulose. FEBS Letts 145: 369-372
|
�@ |
| �@ |
Rigby
PWL, Dieckmann M, Rhodes C, Paul P (1977) Labeling deoxyribonucleic acid
to high specific activity in vitro by nick translation with DNA polymerase
I. J Mol Biol 113:
237-251
|
�@ |
| �@ |
Saiki
RK, Gelfand DH, Stoffel S, Scharf SJ, Higuchi R, Horn GT, Mullis KB,
Erlich HA (1988) Primer-directed enzymatic amplification of DNA with a
thermostable DNA polymerase. Science
239: 487-491
|
�@ |
| �@ |
Sambrook
J, Fritsch EF, Maniatis T (1989) Molecular Cloning: A Laboratory Manual,
ed 2. Cold Spring Harbor Laboratory
Press, USA
|
�@ |
| �@ |
Smith
MR, Devine CS, Cohn SM, Lieberman MW (1984) Quantitative electrophoretic
transfer of DNA from polyacrylamide or agarose gels to nitrocellulose.
Anal Biochem 137: 120-124
|
�@ |
| �@ |
Studier
FW, Moffatt BA (1986) Use of bacteriophage T7 RNA polymerase to direct
selective high level expression of cloned genes. J
Mol Biol 189: 113-130
|
�@ |
| �@ |
Summers
WC (1970) A simple method for extraction of RNA from E. coli
utilizing diethylpyrocarbonate. Anal Biochem 33: 459-463
|
�@ |
| �@ |
Tabor
S, Richardson CC (1985) A bacteriophage T7 RNA polymerase/promoter system
for controlled exclusive expression of specific genes. Proc
Natl Acad Sci USA 82: 1074-1078
|
�@ |
| �@ |
�@ |
�@ |
| �@ |
|
�^�ؿ�
|
| �@ |
Chap3 |
�@ |
