|
|
|||||||||||||||||||||||||||||||||||||||
|
P4 轉印及免疫染色法 Western Transfer & Immunostaining |
|||||||||||||||||||||||||||||||||||||||
|
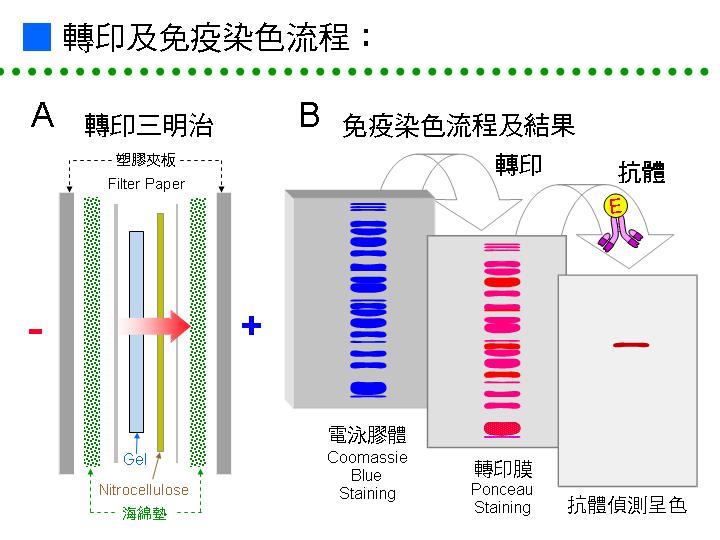
P4A 蛋白質轉印法: |
|||||||||||||||||||||||||||||||||||||||
|
蛋白質電泳膠片經轉印於轉印膜表面後,可以進行免疫染色法、蛋白質 N-端序及酵素活性染色等。 轉印膜 PVDF (polyvinylidene difluoride) 是一種疏水性材質,蛋白質可藉由本身的疏水性部分與其結合。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
儀器用具: |
|||||||||||||||||||||||||||||||||||||||
|
a) 電泳轉印槽 (Hoefer TE22) |
|||||||||||||||||||||||||||||||||||||||
|
b) 轉印紙 (Millipore Immobilon, PVDF)、濾紙 (Whatman 3 mm) |
|||||||||||||||||||||||||||||||||||||||
|
c) 電源供應器 |
|||||||||||||||||||||||||||||||||||||||
|
試劑藥品: |
|||||||||||||||||||||||||||||||||||||||
|
轉印緩衝液 (blotting buffer) 1×: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
標準蛋白質組合: |
|||||||||||||||||||||||||||||||||||||||
|
|
預先染色之分子量標準 (GeneTeks PreBlue Orange Protein Ladder): |
||||||||||||||||||||||||||||||||||||||
|
160, 110, 90, 70 (橘色), 55, 45, 35, 25, 15, 10 kD |
|||||||||||||||||||||||||||||||||||||||
|
操作步驟: |
|||||||||||||||||||||||||||||||||||||||
|
1) 將所要轉印之 SDS-PAGE 或 native-PAGE 膠片浸於轉印緩衝液 (1×) 中,平衡 20~30 min。通常 SDS-PAGE 中的蛋白質分子量較小,因此要加入 10% 的甲醇於轉印緩衝液中,以避免小分子蛋白質過度擴散或穿過轉印膜。 |
|||||||||||||||||||||||||||||||||||||||
|
2) 轉印膜 PVDF 切割成比膠片稍大,因膠片平衡後體積會略漲。 PVDF 為疏水性,必須先以 100% 甲醇短暫溼潤後,再浸入轉印緩衝液 (1×) 中備用。 |
|||||||||||||||||||||||||||||||||||||||
|
3) 取兩張稍大的濾紙,於轉印緩衝液中浸潤備用。取出轉印卡夾,先墊一張多孔性海綿,鋪上一張濾紙,再小心鋪上膠片,勿陷入任何氣泡,鋪上轉印膜,再蓋上一層濾紙及海綿,再把整個膠片卡夾裝好。 |
|||||||||||||||||||||||||||||||||||||||
|
4) 置入已裝有轉印緩衝液 (1×) 的轉印槽中,注意 PVDF 那面朝正極,膠片面朝負極。除去卡夾外面的氣泡,氣泡的存在將使轉印效率變差。 |
|||||||||||||||||||||||||||||||||||||||
|
5) 以 400 mA 進行轉印,於 4℃中轉印 60 min 後中止。取出轉印膜,浸在尿素洗液中洗 1 h 以上;尿素可洗去 SDS-PAGE 樣本蛋白質分子上的 SDS,同時可以將蛋白質分子部分恢復原態,以增加抗體確認機率。 |
|||||||||||||||||||||||||||||||||||||||
|
6) 在電泳過程中若有 pre-stained 的標準蛋白質,可作為轉印效率的參考。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
P4B 酵素免疫染色: |
|||||||||||||||||||||||||||||||||||||||
|
電泳後把蛋白質轉印至 PVDF 轉印膜上,利用專一性抗體對膜上的蛋白質抗原做專一性結合,再用二次抗體對上述抗體進行專一性的結合;而因二次抗體上連結有呈色用的標誌酵素 (多用 horse radish peroxidase, HRP 或 alkaline phosphatase, AP),可呈色而得以偵測。 二次抗體上也可連結 biotin,再藉由 streptavidin 架橋與 biotinylated alkaline phosphatase 結合,一個 avidin 可與四個 biotin 結合;這種免疫染色步驟可達放射性顯像的靈敏度,且其專一性也可增強。 |
|||||||||||||||||||||||||||||||||||||||
|
儀器用具: |
|||||||||||||||||||||||||||||||||||||||
|
a) 平台震盪器 |
|||||||||||||||||||||||||||||||||||||||
|
b) 塑膠染色盤 |
|||||||||||||||||||||||||||||||||||||||
|
c) Autochemi system (UVP) |
|||||||||||||||||||||||||||||||||||||||
|
試劑藥品: |
|||||||||||||||||||||||||||||||||||||||
|
明膠-NET: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
PBS (phosphate buffer saline) 5×: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
PBST (phosphate buffer saline & Tween): |
|||||||||||||||||||||||||||||||||||||||
|
|
PBS 5× 稀釋至 1× 並加入 0.05% (v/v) Tween 20,即成為 PBST。 |
||||||||||||||||||||||||||||||||||||||
|
Urea-PBST: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
一次抗體: |
|||||||||||||||||||||||||||||||||||||||
|
通常要免疫大白兔或小白鼠自行製備一次抗體,一般抗體的使用濃度在 1:1,000 至 1:5,000 之間,視抗體效價而定,使用前以上述 明膠 -NET 稀釋之。 注意每組所分到的一次抗體可能不同,請小心查詢是那一種抗體。 |
|||||||||||||||||||||||||||||||||||||||
|
二次抗體連結體: |
|||||||||||||||||||||||||||||||||||||||
|
通常都可以購得上述一次抗體的二次抗體,並且連結有標誌酵素或者標誌物 (如螢光物或者 biotin);使用濃度依照廠商建議,稀釋在 明膠-NET 中。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
A + B 試劑: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
HRP 呈色劑 DAB: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
操作步驟: |
|||||||||||||||||||||||||||||||||||||||
|
1) 尿素洗過的轉印紙再以 PBST 洗三次,每次 10 min。 |
|||||||||||||||||||||||||||||||||||||||
|
2) 加入一次抗體 (適當濃度溶於明膠-NET 中),室溫下反應 1 h。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
3) 以 PBST 洗 3 次,每次 10 min。 |
|||||||||||||||||||||||||||||||||||||||
|
4) 加入二次抗體 (biotinylated 2nd Ab),室溫下反應 1 h。二次抗體同樣也溶在明膠-NET 中,使用濃度請參考廠商說明書指定濃度。 |
|||||||||||||||||||||||||||||||||||||||
|
5) 以 PBST 洗 3 次,每次 10 min。 |
|||||||||||||||||||||||||||||||||||||||
|
6) 加入預先混合 30 min 之 A + B 試劑,反應 1 h。 |
|||||||||||||||||||||||||||||||||||||||
|
7) 再以 PBS 洗過 2 次後,倒入 HRP 呈色劑 DAB,褐色色帶開始出現。 |
|||||||||||||||||||||||||||||||||||||||
|
8) 呈色約在 10 min 內完成,應當在背景開始加深前中止呈色。 |
|||||||||||||||||||||||||||||||||||||||
|
9) 倒去呈色液,並以蒸餾水清洗數次,取出晾乾後避光保存。 |
|||||||||||||||||||||||||||||||||||||||
|
10) 免疫染色結果的好壞,取決於每次清洗步驟是否完全且徹底;過於隨便的清洗步驟會造成染色結果不良。 |
|||||||||||||||||||||||||||||||||||||||
|
若以化學冷光呈色,則在步驟6) 以後改用以下試劑及呈色方法: |
|||||||||||||||||||||||||||||||||||||||
|
冷光反應劑: |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
6) 吸取冷光反應劑 A、B 各 1 mL 混和均勻後,加入轉印紙上,置於冷光螢光攝像及顯像系統 (UVP AutoChemi system) 中,於 1~3 min 後可以得到免疫染色結果。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
7) 免疫染色結果的好壞,取決於每次清洗步驟是否完全且徹底;過於隨便的清洗步驟會造成染色結果不良。 |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
2011/07/15 |
|||||||||||||||||||||||||||||||||||||||